Continue sua leitura
Sacituzumabe govitecana aprovado para o tratamento do câncer de mama RH positivo nos EUA
Em 03 de fevereiro de 2023, o FDA (Food and Drug Administration) aprovou o uso do anticorpo conjugado à droga (ACD) sacituzumabe govitecana para o tratamento do câncer de mama com expressão de receptores hormonais (RH positivo) HER-2 negativo metastático após exposição prévia a tratamento hormonal e pelo menos duas linhas adicionais de tratamento sistêmico.
A aprovação é baseada nos dados do estudo de fase III TROPiCS-02, que randomizou 543 pacientes com câncer de mama RH positivo HER-2 negativo metastático após progressão ao tratamento com um inibidor de CDK4/6, terapia hormonal e um agente taxano. Os pacientes precisavam ter recebido previamente duas linhas de quimioterapia no cenário metastático (uma das linhas poderia ter sido administrada no cenário neoadjuvante ou adjuvante caso a recorrência tivesse ocorrido em um período ≤ 12 meses após o tratamento). A randomização ocorreu em uma razão 1:1 entre sacituzumabe govitecana ou quimioterapia à escolha do investigador (eribulina, vinorelbina, gencitabina ou capecitabina). A idade mediana da população foi 56 anos, sendo 26% com idade ≥ 65 anos. O número mediano de tratamentos prévios no cenário metastático foi 3, sendo que 58% haviam recebido 3 ou 4 linhas de tratamento prévias. Destaca-se que 95% dos pacientes possuíam metástases viscerais.
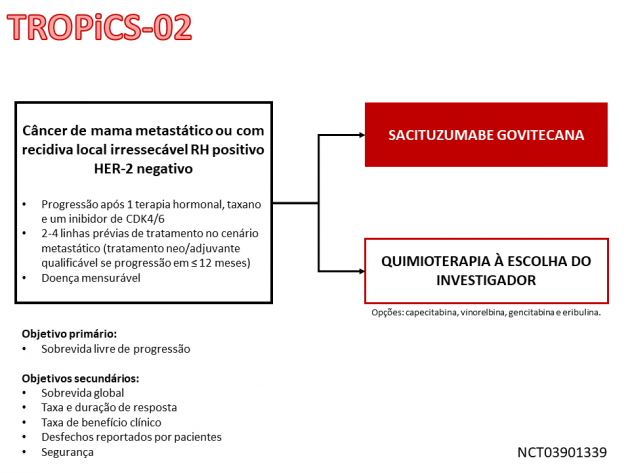
O estudo atingiu seu objetivo primário, demonstrando redução de 34% no risco de progressão de doença ou morte em favor do braço tratado com sacituzumabe govitecana (HR=0,66; IC de 95%: 0,53-0,83; p =0,0003). Além disso, foi demonstrado benefício em sobrevida global (medianas de 14,4 versus 11,2; HR=0,79; IC de 95%: 0,65-0,96; p=0,02) e taxa de resposta (21% versus 14%; p=0,03) em favor do braço que recebeu o ACD.
A duração mediana de resposta com sacituzumabe govitecana foi de 8,1 meses. A taxa de eventos adversos graves no braço de sacituzumabe govitecana foi de 28%, destacando-se como eventos adversos mais frequentes em qualquer grau: leucopenia, neutropenia, anemia, linfopenia, diarreia, fadiga, náuseas, alopecia, aumento de glicemia, constipação e hipoalbuminemia.
Conforme destaca a Dra. Juliana Martins Pimenta, oncologista da BP – A Beneficência Portuguesa de São Paulo: “O sacituzumabe govitecana foi recentemente aprovado no Brasil para tratamento do câncer de mama triplo negativo metastático devido seus excelentes resultados no estudo ASCENT. Apesar de menos impressionantes, os resultados no tratamento do câncer de mama RH positivo HER-2 negativo metastático também tornam esta medicação uma opção terapêutica importante para este subtipo de tumor com prognóstico geralmente mais favorável e no qual o uso de tratamentos sequenciais permite sobrevida prolongada. Dessa forma, aprovações de novos tratamentos são importantes e necessários para melhores desfechos nesta neoplasia. Com a aprovação atual pelo FDA, é esperado que em breve esse ACD também seja aprovado pela ANVISA para o tratamento do câncer de mama RH positivo HER-2 negativo no nosso país”.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
