Continue sua leitura
Duas novas opções de tratamento imunoterápicos aprovados para o câncer de pulmão avançado nos EUA
O FDA (Food and Drug Administration) recentemente divulgou a aprovação de duas novas opções de inibidores de checkpoint para o tratamento de primeira linha do câncer de pulmão de células não pequenas metastático com ausência de alterações nos genes EGFR e ALK: a combinação de nivolumabe e ipilimumabe para tumores com expressão de PDL-1 ≥ 1%, e o uso de atezolizumabe em monoterapia para aqueles com alta expressão de PDL-1 (definido como positividade no estudo imunohistoquímico em ≥ 50% das células tumorais ou ≥ 10% das células imunes do infiltrado tumoral na avaliação pelo anticorpo SP142).
A primeira aprovação é baseada nos dados do estudo clínico de fase III CheckMate 227, que avalia o uso de nivolumabe isolado, nivolumabe combinado a ipilimumabe, nivolumabe combinado a quimioterapia, ou quimioterapia isolada no tratamento de primeira linha de pacientes com câncer de pulmão de células não pequenas metastático através de um design complexo para a realização de diferentes análises. Na parte 1a deste estudo, 793 pacientes portadores de tumores com expressão de PDL-1 ≥ 1% foram randomizados para receber tratamento com nivolumabe e ipilimumabe ou quimioterapia baseada em dupla de platina. O tratamento com nivolumabe e ipilimumabe foi associado a benefício em sobrevida global, com mediana de 17,2 meses nos pacientes tratados com nivolumabe e ipilimumabe e 14,9 meses no braço que recebeu quimioterapia (HR=0,79; IC de 95%: 0,67-0,94; p = 0,0066). A sobrevida livre de progressão mediana avaliada por revisão central independente foi 5,1 meses no braço experimental e 5,6 meses no braço controle (HR=0,82; IC de 95%: 0,69-0,97), e a taxa de reposta confirmada foi 36% e 30% nos mesmos braços, respectivamente. Destaca-se a duração de resposta de 23,2 meses nos pacientes tratados com nivolumabe e ipilimumabe e 6,2 meses naqueles que receberam quimioterapia.
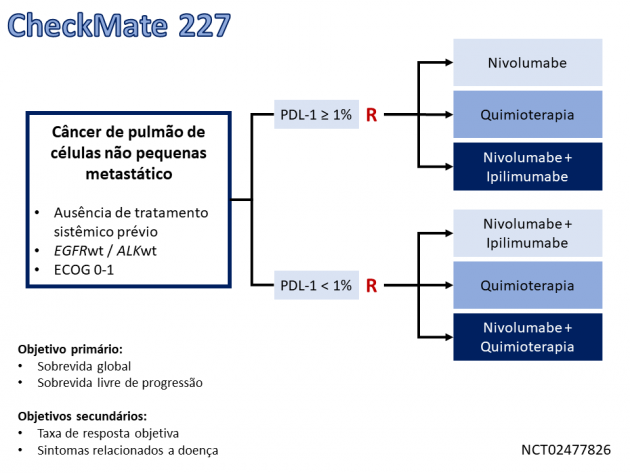
Os eventos adversos mais frequentes com a combinação de imunoterápicos foram fadiga, rash, redução do apetite, dor musculoesquelética, diarreia/colite, dispneia, tosse, prurido, náuseas e hepatite, e a taxa de eventos adversos de graus ≥ 3 foi 32,8%.
A dose de tratamento recomendada é nivolumabe 3 mg/kg a cada 2 semanas e ipilimumabe 1 mg/kg a cada 6 semanas até progressão de doença, toxicidade limitante, ou até completar 2 anos de tratamento (dado que não ocorra progressão de doença).

Quanto ao uso de atezolizumabe, a nova indicação de tratamento aprovada tem como base os resultados do estudo clínico de fase III IMpower110, que randomizou 572 pacientes com tumores apresentando expressão de PDL-1 ≥ 1% entre tratamento de primeira linha com atezolizumabe ou quimioterapia baseada em platina. O tratamento com atezolizumabe foi associado a maior sobrevida global em comparação ao uso de quimioterapia no subgrupo de pacientes com alta expressão de PDL-1 (medianas de 20,2 versus 13,1 meses, HR=0,59; IC de 95%: 0,40-0,89; p = 0,0106). Entretanto, não foi encontrada diferença na sobrevida global quando a análise foi conduzida nos pacientes cujos tumores apresentam expressão de PDL-1 moderada (≥ 5% nas células tumorais ou no infiltrado inflamatório) ou fraca (≥ 1% nas células tumorais ou no infiltrado inflamatório). A sobrevida livre de progressão mediana na população com alta expressão de PDL-1 foi 8,1 meses com o uso de atezolizumabe e 5,0 meses com o uso de quimioterapia (HR=0,63; IC de 95%: 0,45-0,88; p = 0,007). A taxa de resposta confirmada com o uso do imunoterápico também foi superior ao uso de quimioterapia nessa população (38,3% versus 28,6%).
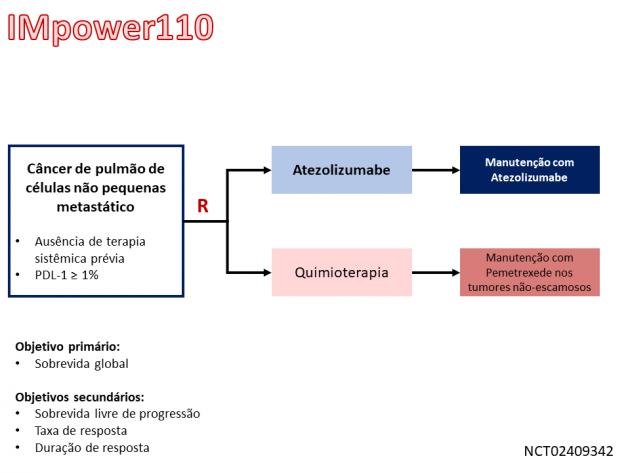
O tratamento com atezolizumabe foi associado a eventos adversos relacionados ao tratamento de graus ≥ 3 em 12,9% dos pacientes, sendo fadiga/astenia o evento adverso mais frequente em qualquer grau.
Três diferentes regimes de administração são recomendados para a nova indicação de tratamento aprovada: atezolizumabe 840 mg a cada 2 semanas, 1.200 mg a cada 3 semanas, ou 1.680 mg a cada 4 semanas.

Por Dr. Daniel Vargas P. de Almeida
Veja também:
- [NOTÍCIA] O que muda no MOC após a ESMO 2019
- [VÍDEO] ESMO 2019: Dr. William William – Updates na primeira linha do câncer de pulmão metastático (FLAURA, IMPower 110 e Checkmate 227)
- [VÍDEO] ESMO 2019: Dr. Federico Cappuzzo – FLAURA, IMpower110 e CheckMate 227
- [NOTÍCIA] Combinação de imunoterapia atinge resultados positivos em primeira linha de tratamento para câncer de pulmão
