Continue sua leitura
Dispositivo de administração programada de Neulastim® é aprovado no Brasil
Os fatores estimuladores de colônia de granulócitos são parte de alguns regimes quimioterápicos com maior risco de neutropenia febril. Facilitando a vida dos pacientes que necessitam desse tratamento profilático, a ANVISA aprovou em 29 de junho de 2020 o sistema de aplicação automática Neulastim On-body Injector®, trazendo mais conveniência e segurança durante o tratamento oncológico. O dispositivo é simples e prático de usar. A aplicação é realizada no paciente na unidade de quimioterapia e o medicamento (pegfilgrastim) é liberado automaticamente após 27 horas, poupando o paciente de retornar à clinica.
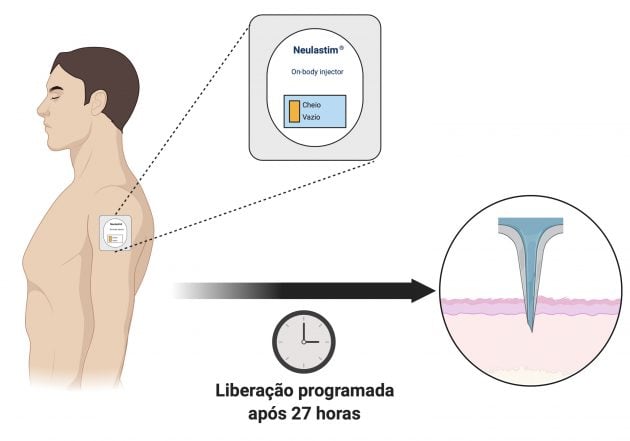
A eficácia e segurança do dispositivo Neulastim On-body Injector® foi avaliada através de dois estudos clínicos. No primeiro desses estudos, a performance do dispositivo foi avaliada em 150 indivíduos submetidos a 297 aplicações de placebo utilizado o on-body injector. A administração foi bem-sucedida em 98,3% dos casos, não sendo reportada a ocorrência de nenhum evento adverso grave. No segundo estudo, 253 indivíduos saudáveis foram randomizados entre a administração de pegfilgrastim através do dispositivo on-body injector ou através da seringa pré-preenchida convencional, e foram analisados os parâmetros farmacocinéticos entre os grupos. A taxa (Cmáx) e a extensão (AUC0-inf) da absorção de pegfilgrastim administrado pelo on-body injector foram semelhantes às da injeção manual da seringa preenchida. As razões médias geométricas dos mínimos quadrados (on-body injector para injeção manual) foram de 0,97 (IC de 90%: 0,83-1,14) para Cmáx e 1,00 (IC de 90%: 0,84-1,20) para AUC0-inf. Os resultados situaram-se dentro dos limites de bioequivalência pré-especificados (0,80-1,25), estabelecendo a bioequivalência entre os dois métodos de administração de uma dose única de 6 mg de pegfilgrastim.
A farmacêutica Amgen®, responsável pela comercialização do dispositivo, informou que agora o produto segue para a etapa de precificação, porém o valor será o mesmo da seringa pré-preenchida.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
