Continue sua leitura
Tratamento adjuvante com T-DM1 é aprovado nos EUA
O tumor de mama é a neoplasia de maior incidência na população americana, com um índice estimado de aproximadamente 268.000 novos casos para o ano de 2019. Classicamente caracterizado como marcador de agressividade, a amplificação ou superexpressão de HER-2 está presente em 15-20% dos tumores de mama. Após o desenvolvimento e aprovação de terapias direcionadas especificamente para bloquear esse alvo, a história natural dessa doença foi drasticamente alterada. No entanto, pacientes que recebem poliquimioterapia em combinação com terapia anti-HER-2 no cenário neoadjuvante e que falham em atingir resposta patológica completa possuem um risco de recidiva bastante elevado, o que motivou a condução de estudo de troca de estratégia na adjuvância para pacientes que se encontram nesse contexto.
O FDA (Food and Drug Administration) anunciou, em 03 de maio de 2019, a aprovação de T-DM1 (trastuzumabe entansina) para o tratamento adjuvante do câncer de mama inicial HER-2 positivo nas pacientes que apresentaram doença residual após tratamento quimioterápico neoadjuvante, baseado nos dados do estudo de fase III KATHERINE.
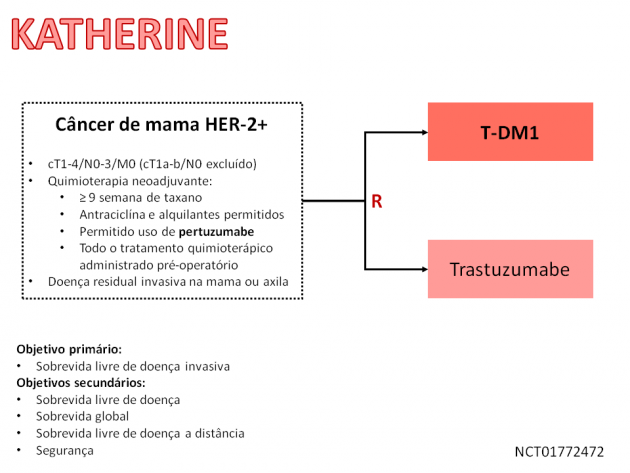 O benefício desse tratamento foi avaliado em 1.486 pacientes, as quais foram randomizadas 1:1 para receber tratamento adjuvante com T-DM1 ou trastuzumabe por 14 ciclos após apresentarem doença residual invasiva (na mama ou linfonodos axilares). Todas as pacientes recrutadas haviam recebido terapia neoadjuvante prévia com quimioterapia baseada em taxano e trastuzumabe, com ou sem associação de pertuzumabe. Em análise interina dos dados, com seguimento mediano de 40 meses, o estudo alcançou seu desfecho primário, promovendo uma redução relativa de 50% no risco de recorrência de doença invasiva ou morte, no grupo tratado com T-DM1 em detrimento de trastuzumabe na adjuvância. Houve ainda 40% de redução no risco de recidiva à distância no grupo tratado com o anticorpo conjugado à droga. Os dados de sobrevida global ainda são imaturos na presente análise, mas já parecem indicar abertura das curvas de sobrevida, favorecendo uso de T-DM1. Nas análises de segurança, a taxa de eventos adversos de grau igual ou superior a 3 foi de 25% no tratamento com T-DM1, destacando-se como principais eventos a ocorrência de fadiga, náuseas, elevação de transaminases hepáticas, mialgia, artralgia e plaquetopenia.
O benefício desse tratamento foi avaliado em 1.486 pacientes, as quais foram randomizadas 1:1 para receber tratamento adjuvante com T-DM1 ou trastuzumabe por 14 ciclos após apresentarem doença residual invasiva (na mama ou linfonodos axilares). Todas as pacientes recrutadas haviam recebido terapia neoadjuvante prévia com quimioterapia baseada em taxano e trastuzumabe, com ou sem associação de pertuzumabe. Em análise interina dos dados, com seguimento mediano de 40 meses, o estudo alcançou seu desfecho primário, promovendo uma redução relativa de 50% no risco de recorrência de doença invasiva ou morte, no grupo tratado com T-DM1 em detrimento de trastuzumabe na adjuvância. Houve ainda 40% de redução no risco de recidiva à distância no grupo tratado com o anticorpo conjugado à droga. Os dados de sobrevida global ainda são imaturos na presente análise, mas já parecem indicar abertura das curvas de sobrevida, favorecendo uso de T-DM1. Nas análises de segurança, a taxa de eventos adversos de grau igual ou superior a 3 foi de 25% no tratamento com T-DM1, destacando-se como principais eventos a ocorrência de fadiga, náuseas, elevação de transaminases hepáticas, mialgia, artralgia e plaquetopenia.
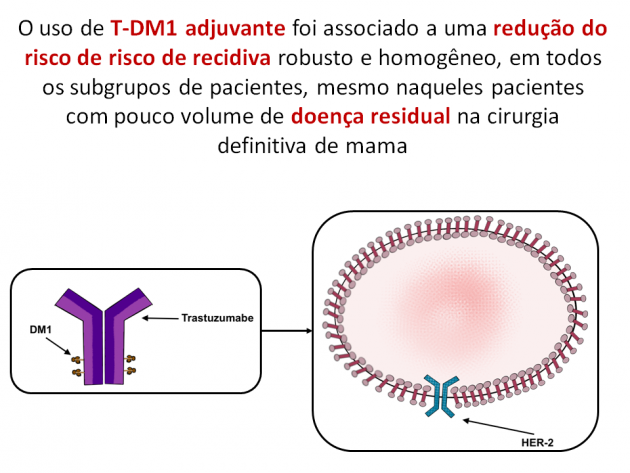
Dra. Debora Gagliato, oncologista da BP – A Beneficência Portuguesa de São Paulo, ressalta que “após esses dados, o FDA concedeu designação de breakthrough therapy para o uso de T-DM1 no cenário de doença residual pós-terapia sistêmica na doença HER-2, positiva, permitindo que a indicação fosse revisada de maneira ágil, sob a tutela do FDA’s Real-Time Oncology Review Pilot Program. Mediante avaliação nesse programa, há o claro objetivo de encurtar ao máximo o período necessário até que a medicação esteja disponível para uso na prática clínica dos pacientes com indicação. Tal mecanismo de aprovação é fundamental, uma vez que o uso da droga acarretou um ganho em redução do risco de risco de recidiva robusto e homogêneo em todos os subgrupos de pacientes, mesmo naqueles pacientes com pouco volume de doença residual na cirurgia definitiva de mama. Trata-se de importante avanço no manejo de uma parcela de pacientes com câncer de mama HER-2+ de particular alto risco, em que o oncologista agora possui T-DM1 como alternativa de resgate bastante eficaz”.
“Ressaltamos que com essa evidência e nova aprovação, há crescente importância da interação entre oncologistas e cirurgiões mamários, para discussão sobre consideração de neoadjuvância em pacientes diagnosticados com carcinoma de mama HER-2+ localizado”, conclui a Dra. Debora.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
- [Notícia] MOC 2019 | O que mudou nos capítulos de Mama
- [Vídeo] San Antonio 2018: Dr. Buzaid e Dras. Juliana Pimenta e Debora Gagliato – Neoadjuvância
- [Vídeo] San Antonio 2018: Dr. Buzaid e Dras. Juliana Pimenta e Debora Gagliato – HIGHLIGHTS
- [Vídeo] San Antonio 2018: Dr. Marcio Debiasi – Estudo KATHERINE
