Continue sua leitura
ANVISA aprova olaparibe adjuvante para o tratamento do câncer de mama
Em 18 de julho de 2022, a ANVISA (Agência Nacional de Vigilância Sanitária) aprovou o uso do inibidor da PARP olaparibe para o tratamento adjuvante de pacientes com câncer de mama HER-2 negativo inicial de risco alto apresentando mutação germinativa patogênica ou possivelmente patogênica no gene BRCA após tratamento com quimioterapia neoadjuvante ou adjuvante.
A aprovação foi baseada no estudo OlympiA, que randomizou 1.836 pacientes com câncer de mama HER-2 negativo inicial de risco alto a uma razão 1:1 entre olaparibe ou placebo por 1 ano. Adicionalmente, neste estudo foi necessária a administração de todo o tratamento local (incluindo cirurgia e radioterapia) além de quimioterapia neoadjuvante ou adjuvante por ao menos 6 meses utilizando antraciclinas, taxanos ou ambos (permitido também o uso de agentes platinantes) antes da randomização. Naquelas pacientes com tumores expressando receptores hormonais, o tratamento hormonal foi administrado concomitante a olaparibe ou placebo. Dentre os critérios de inclusão no estudo, foram consideradas pacientes com risco alto aquelas com tumores triplo-negativos apresentando doença residual após tratamento quimioterápico neoadjuvante e aquelas com tumor primário ≥ 2 cm ou comprometimento linfonodal axilar em caso de tratamento cirúrgico primário. Já os tumores com receptores hormonais positivos foram considerados de risco alto caso as pacientes apresentassem doença residual com CPS+EG score ≥ 3 se tivessem recebido tratamento quimioterápico neoadjuvante, ou com comprometimento de ≥ 4 linfonodos axilares naquelas submetidas a cirurgia como primeiro tratamento.
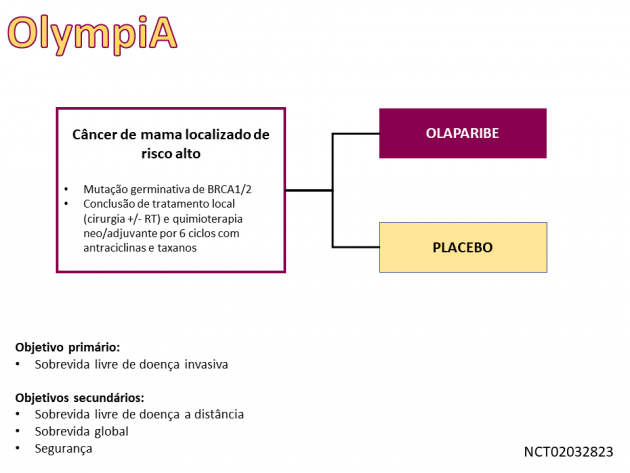
A sobrevida livre de doença invasiva, objetivo primário do estudo, foi de 86% versus 77% nos braços olaparibe e placebo, respectivamente, aos 3 anos (HR=0,58; IC de 95%: 0,46-0,74; p<0,0001). Dados atualizados do estudo foram apresentados na sessão ESMO Virtual Plenary, incluindo nova análise da sobrevida global que também demonstrou redução de 32% no risco de morte em favor do braço olaparibe (HR=0,68; IC de 98,5%: 0,47-0,97; p=0,009), sendo que a principal causa de morte nas pacientes foi recidiva do câncer de mama (93,3% e 94,5% nos braços olaparibe e placebo, respectivamente). A taxa de eventos adversos de graus ≥ 3 foi de 24,5% no braço olaparibe, destacando-se náuseas, fadiga, anemia, vômitos e cefaleia como as toxicidades mais frequentes em qualquer grau.
A dose indicada para o uso de olaparibe neste cenário adjuvante é 300 mg, via oral, duas vezes ao dia durante um ano de tratamento.
Segundo a Dra. Debora Gagliato, oncologista clínica da BP- A Beneficência Portuguesa de São Paulo: “o estudo OlympiA claramente muda a prática clínica ao demonstrar que olaparibe é associado a redução no risco de progressão e morte nos pacientes que atendem aos critérios de inclusão do estudo. É imprescindível a identificação dos indivíduos portadores de mutação patogênica em BRCA 1 ou 2 através de avaliação molecular germinativa. O impacto e implicação do uso de olaparibe na adjuvância de pacientes diagnosticados com câncer de mama de risco alto é tão substancial, que o Guideline atual do NCNN sugere a realização de teste molecular germinativo universal para pacientes com câncer de mama localizado HER-2 negativo de risco alto, que atendem aos critérios de inclusão do estudo OlympiA. Todos os subgrupos de pacientes incluídos no estudo se beneficiam da droga, sendo a interpretação do efeito do tratamento em subgrupos específicos limitada pelo baixo número de eventos e seguimento ainda curto. Ressaltamos, portanto, que o ganho foi consistente e sem evidência de heterogeneidade significativa entre os principais subgrupos avaliados”.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
