Continue sua leitura
Novo regime aprovado como tratamento de manutenção para o câncer de ovário avançado nos EUA
O FDA (Food and Drug Administration) aprovou em 08 de maio de 2020 o uso combinado de olaparibe e bevacizumabe como terapia de manutenção em pacientes com câncer de ovário, tubas uterinas ou peritônio com deficiência de recombinação homóloga que apresentaram resposta parcial ou completa após tratamento de primeira linha com quimioterapia baseada em platina.
A eficácia do regime de manutenção combinado foi avaliada no estudo de fase III PAOLA-1. Nele, 806 pacientes com câncer de ovário, tubas uterinas ou peritônio de alto grau estádios FIGO III ou IV foram randomizadas a uma razão 2:1 para receberem tratamento de manutenção com bevacizumabe associado a olaparibe (N = 537) ou placebo (N = 269) após apresentarem resposta parcial ou completa a quimioterapia de primeira linha baseada em platina. A administração de bevacizumabe foi mantida por 15 meses após a randomização, enquanto o tratamento com olaparibe/placebo foi realizado por 24 meses. Ressalta-se que o status de deficiência de recombinação homóloga neste estudo foi definido como a presença de mutação deletéria ou possivelmente deletéria no gene BRCA e/ou instabilidade genômica de acordo com avaliação pelo teste Myriad myChoice® (também aprovado pelo FDA como teste complementar para o uso do regime combinado).
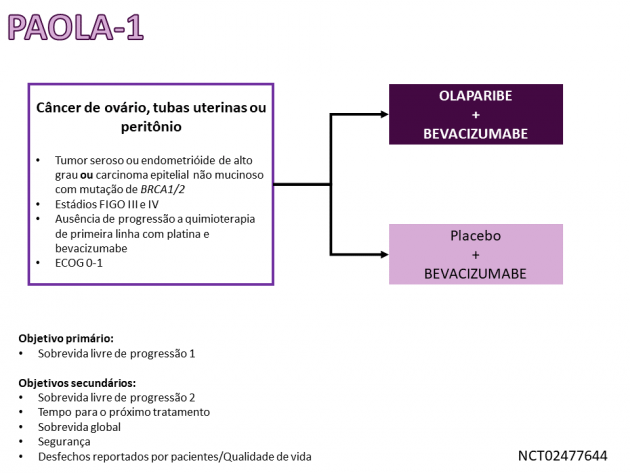
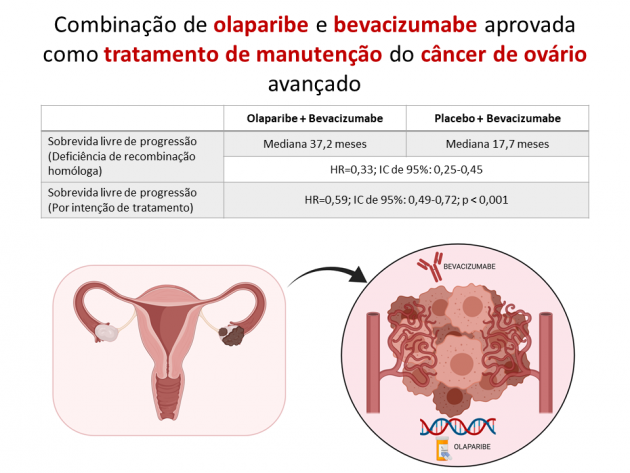
Após um seguimento mediano de 22,9 meses, o tratamento com bevacizumabe e olaparibe reduziu em 67% o risco de progressão de doença ou morte em comparação ao braço que recebeu placebo quando a análise foi restrita às 387 pacientes com deficiência de recombinação homóloga (HR=0,33; IC de 95%: 0,25-0,45). Nessa população, a sobrevida livre de progressão mediana foi 37,2 meses no braço olaparibe e 17,7 meses no braço placebo. O tratamento com bevacizumabe e olaparibe também foi associado a benefício em sobrevida livre de progressão na análise da população por intenção de tratamento (HR=0,59; IC de 95%: 0,49-0,72; p < 0,001), objetivo primário do estudo. Os dados de sobrevida global ainda são imaturos. Na análise de segurança, 57% das pacientes tratadas com bevacizumabe e olaparibe apresentaram eventos adversos de graus ≥ 3, destacando-se fadiga, náuseas, hipertensão, anemia e linfopenia como os eventos adversos mais comuns de qualquer grau.
A Dra. Graziela Zibetti Dal Molin, oncologista da Beneficência Portuguesa de São Paulo, comenta: “Trata-se de mais uma aprovação importante no cenário de manutenção pós tratamento de primeira linha no câncer de ovário. Cerca de 50% das pacientes com câncer de ovário apresentam algum tipo de deficiência em recombinação homóloga, contudo ainda há incertezas sobre o uso do teste de recombinação homóloga utilizado em diversos estudos de fase III na predição de resposta ao uso de inibidores de PARP”.
“A combinação de bevacizumabe e olaparibe poderá beneficiar principalmente pacientes que já teriam indicação de uso de bevacizumabe em primeira linha, como aquelas com citorredução incompleta, estádio IV ou com grande volume de ascite”, complementa Dra. Graziela.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
