Continue sua leitura
Novo inibidor da PARP aprovado para tratamento de manutenção do câncer de ovário nos EUA
O inibidor da PARP – poly (ADP-ribose) polymerase niraparibe recebeu aprovação pelo FDA (Food and Drug Administration) em 29 de abril de 2020 para o tratamento de manutenção de pacientes com câncer de ovário, tubas uterinas ou peritônio avançado de grau alto que apresentaram resposta ao tratamento sistêmico de primeira linha com quimioterapia baseada em platina.
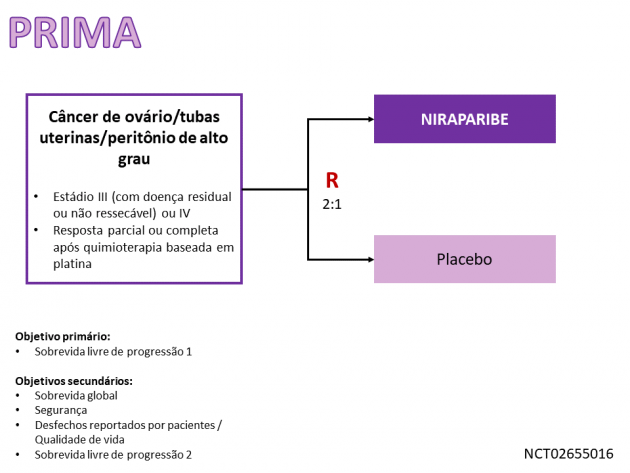
Os dados que motivaram a aprovação da droga resultaram do estudo de fase III PRIMA, que randomizou 733 pacientes com doença nos estádios III (com tumor residual após cirurgia primária ou não ressecável cirurgicamente) ou IV para receberem niraparibe ou placebo como terapia de manutenção após apresentarem resposta parcial ou completa a 6-9 ciclos de quimioterapia sistêmica baseada em platina. O objetivo primário do estudo foi a análise da sobrevida livre de progressão, avaliada de maneira hierárquica nas pacientes com deficiência de recombinação homóloga, seguida da avaliação em todas as pacientes incluídas no estudo. Após um seguimento mediano de 13,8 meses, o tratamento com niraparibe foi associado a maior sobrevida livre de progressão em ambas as populações avaliadas; quando consideradas todas as pacientes, a sobrevida livre de progressão mediana foi prolongada de 8,2 para 13,8 meses com o uso de niraparibe (HR=0,62; IC de 95%: 0,50-0,76; p < 0,001). A análise da sobrevida global é um dos desfechos secundários do estudo, e os dados ainda imaturos demonstram uma taxa de sobrevida aos 2 anos de 77% e 84% nos grupos placebo e niraparibe, respectivamente (HR=0,70; IC de 95%: 0,44-1,11). A taxa de eventos adversos de graus ≥ 3 foi 70,5% no braço tratado com niraparibe, destacando-se anemia, náuseas, trombocitopenia, constipação e fadiga como as toxicidades com maior incidência em qualquer grau.
As dosagens recomendadas para o tratamento são de 200 mg, via oral (VO), diariamente, nas pacientes com peso < 77 quilogramas ou com contagem de plaquetas < 150.000/mm3, e de 300 mg, VO, diariamente, nas demais pacientes.
A Dra. Graziela Zibetti Dal Molin, oncologista da BP destaca: “O estudo PRIMA corrobora o papel dos inibidores de PARP (iPARP) no tratamento do câncer de ovário. Niraparibe já está aprovado pelo FDA como manutenção da doença platino sensível, como tratamento em pacientes politratadas e agora também como manutenção em primeira linha. Trata-se de um grande ganho para as pacientes por haver mais uma opção no tratamento de manutenção de primeira linha. As toxicidades apresentadas são muito semelhantes a outros estudos de fase III com iPARP, mostrando que algumas delas como náuseas, vômitos e fadiga podem ser consideradas como efeito de classe”.
“Sua aprovação foi independente do status de qualquer biomarcador, como BRCA ou deficiência de recombinação homóloga, dado o benefício em toda a população do estudo. Contudo, a tecnologia utilizada hoje para avaliação do status de recombinação homóloga ainda não é capaz de predizer com exatidão quais pacientes não terão o benefício do uso de iPARP, motivo pelo qual a aprovação foi para toda população. Avanços no refinamento de biomarcadores poderão auxiliar futuramente na medicina de precisão no câncer de ovário”, conclui Dra. Graziela.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
- [NOTÍCIA] Novo inibidor de PARP aprovado para o tratamento do câncer de ovário nos EUA
- [NOTÍCIA] O que muda no MOC após a ESMO 2019
- [VÍDEO] ESMO 2019: Dra. Graziela Zibetti Dal Molin e Dra. Angélica Nogueira – Estudos PAOLA, PRIMA e VELIA
- [VÍDEO] ESMO 2019: Dr. Bradley J. Monk – Destaques em câncer de ovário do Presidential Symposium
- [VÍDEO] ASCO 2019: Dra. Juliana Pimenta e Dra. Graziela Zibetti Dal Molin – Destaques em Câncer Ginecológico
