Continue sua leitura
Imunoterapia aprovada no tratamento de primeira linha do carcinoma hepatocelular nos EUA
O uso de inibidores de checkpoint imunológicos é associado a benefícios relevantes em tumores de diferentes sítios primários. Aumentando o espectro de indicações para o uso dessa classe de drogas nos Estados Unidos, o FDA (Food and Drug Administration) anunciou em 29 de maio de 2020 a aprovação do regime combinado de atezolizumabe e bevacizumabe no tratamento de pacientes portadores de carcinoma hepatocelular irressecável ou metastático sem história de tratamento sistêmico prévio, conforme os dados do estudo de fase III IMbrave150.
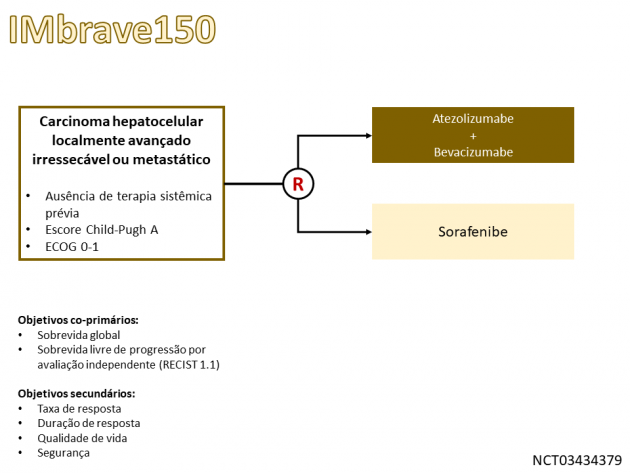
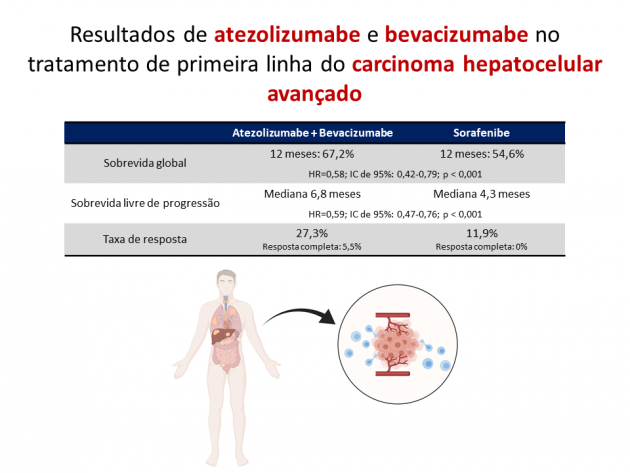
Neste estudo, 501 pacientes foram randomizados entre tratamento de primeira linha com a combinação de atezolizumabe e bevacizumabe ou sorafenibe. Destaca-se que, de acordo com os critérios de elegibilidade do estudo, foi permitida apenas a inclusão de pacientes com escore de Child-Pugh A e a presença de varizes esofagianas ou gástricas com risco de sangramento não tratadas foi apontado como um critério de exclusão. Após um seguimento mediano de 8,6 meses, o estudo atingiu seu objetivo primário ao demonstrar que o tratamento com atezolizumabe e bevacizumabe foi associado a uma redução de 42% no risco de morte em comparação ao uso de sorafenibe (HR=0,58; IC de 95%: 0,42-0,79; p < 0,001), com taxas de sobrevida aos 12 meses de 67,2% e 54,6% nos mesmos braços, respectivamente. Adicionalmente, a sobrevida livre de progressão, objetivo co-primário do estudo, também favoreceu no grupo de pacientes tratados com atezolizumabe e bevacizumabe (HR=0,59; IC de 95%: 0,47-0,76; p < 0,001). A taxa de resposta foi superior no braço que recebeu o tratamento combinado, tanto na análise através do RECIST 1.1 (27,3% versus 11,9%) quanto através do RECIST modificado (33,2% versus 13,3%), além de incluir 5,5% de respostas completas no braço tratado com atezolizumabe e bevacizumabe. A taxa de eventos adversos graves foi 38% no braço experimental e 30,8% no braço controle. Os eventos adversos mais frequentes nos pacientes tratados com atezolizumabe e bevacizumabe foram hipertensão arterial, fadiga, proteinúria, elevação de transaminases e prurido.
Por Dr. Daniel Vargas P. de Almeida
