Continue sua leitura
Tratamento de manutenção oral aprovado para o câncer de pâncreas avançado
O desenvolvimento de terapias mais eficazes para o câncer de pâncreas permanece como um grande desafio da oncologia. A despeito de sua incidência relativamente baixa, sendo responsável por apenas 3,2% dos novos casos de câncer nos Estados Unidos, a doença é diagnosticada em estádio avançado na maioria dos pacientes (53% com doença metastática), e a taxa de sobrevida em 5 anos é pequena em todos os estádios (37,4% para pacientes com doença inicial e 2,9% nos casos de doença metastática). Contribuindo para o aumento das opções terapêuticas na doença avançada, o FDA (Food and Drug Administration) aprovou em 27 de dezembro de 2019 o uso do inibidor de PARP olaparibe como terapia de manutenção em pacientes com mutações germinativas de BRCA1 e/ou BRCA2 que não tenham progredido durante as primeiras 16 semanas de tratamento de primeira linha baseado em platina.
Olaparibe foi avaliado neste cenário no estudo clínico de fase III POLO, apresentado na ASCO 2019 e subsequentemente publicado no periódico New England Journal of Medicine. Nele, 154 pacientes com adenocarcinoma de pâncreas avançado portadores de mutação germinativa no gene BRCA foram randomizados a uma razão 3:2 para receberem olaparibe ou placebo como terapia de manutenção após o tratamento com uma linha de quimioterapia baseado em platina à escolha do investigador (a maioria da população recebeu FOLFIRINOX, FOLFOX ou GEMOX). O objetivo primário do estudo foi atingido, demonstrando que o uso de olaparibe reduziu em 47% o risco relativo de progressão de doença ou morte quando comparado a placebo (HR=0,53; IC de 95%: 0,35-0,82; p=0,004), prolongando a sobrevida livre de progressão mediana de 3,8 para 7,4 meses. Dentre os objetivos secundários, a taxa de resposta objetiva foi superior no grupo de pacientes tratados com olaparibe (23% versus 12%). Com apenas 46% dos desfechos, a análise de sobrevida global ainda é imatura, e desta forma, necessitamos de um maior follow-up para avaliar o impacto da terapia neste desfecho. Adicionalmente, uma análise complementar do estudo demonstrou que o tratamento com olaparibe não teve impacto negativo na qualidade de vida relacionada à saúde.
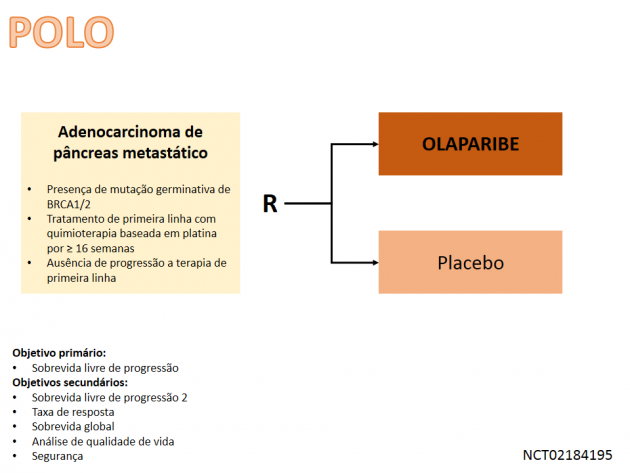
As análises de segurança demonstraram um perfil de eventos adversos compatíveis com estudos prévios utilizando a droga, revelando que 40% dos pacientes apresentaram eventos adversos de graus maior ou igual a 3, e a taxa de descontinuação do tratamento por eventos adversos foi de 5%. A dose recomendada para o tratamento como olaparibe nesse cenário é de 300 mg administrados por via oral duas vezes ao dia.
Segundo o oncologista Dr. Ricardo Carvalho, da BP – A Beneficência Portuguesa de São Paulo, “este estudo foi um enorme avanço, pois abre uma janela de oportunidade para os pacientes cujo cenário de tratamento ainda é bastante desanimador”.
O especialista comenta que “ainda não sabemos como conduzir os pacientes com mutações somáticas no BRCA1 e/ou BRCA2, e aqueles com mutações germinativas de significado incerto (por exemplo ATM, PALB2 e CDKN2), pois estes pacientes não foram incluídos no estudo POLO. Outra questão importante é que no caso daqueles pacientes em que usamos FOLFIRINOX como tratamento de primeira linha é uma prática comum a realização de manutenção com fluoropirimidina exclusiva, esquema de tratamento que não foi utilizado no braço controle do estudo POLO (utilizou-se placebo como manutenção). Dessa forma, não sabemos se a manutenção com olaparibe oferece melhores resultados em comparação à manutenção com fluoropirimidina. Por fim, este estudo mudou a prática clínica, tornando obrigatória a realização da pesquisa de mutações germinativas em todos os pacientes com câncer de pâncreas metastático (recomendação sugerida pelo NCCN)”.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
