Continue sua leitura
Trastuzumabe deruxtecana recebe aprovação definitiva nos EUA
O FDA (Food and Drug Administration) concedeu em 04 de maio de 2022 a aprovação definitiva ao anticorpo conjugado à droga trastuzumabe deruxtecana para o tratamento de pacientes com câncer de mama HER-2 positivo irressecável ou metastático que receberam anteriormente uma linha de terapia anti-HER-2 no cenário metastático, ou que foram tratadas em contexto neoadjuvante ou adjuvante, seguido de recorrência da doença durante o tratamento ou dentro de 6 meses após a conclusão dele. Tal aprovação ocorreu através do programa intitulado FDA’s Real-Time Oncology Review. Anteriormente, em dezembro de 2019, a medicação havia recebido uma aprovação acelerada do FDA para uso em pacientes com câncer de mama HER-2 positivo metastático que já haviam recebido 2 ou mais regimes anteriores anti-HER-2 em contexto de doença avançada.
A nova aprovação é baseada nos resultados do estudo de fase III DESTINY-Breast03 (DB03), que avaliou 524 pacientes com câncer de mama metastático HER-2 positivo previamente tratadas com trastuzumabe e taxano para a doença metastática ou com recidiva em ≤ 6 meses do tratamento neoadjuvante ou adjuvante. As pacientes foram randomizadas 1:1 para receberem trastuzumabe deruxtecana ou trastuzumabe entansina (T-DM1). Dentre a população estudada, a maioria das pacientes (89%) possuía alta expressão de HER-2 (imunohistoquímica 3+), 70% possuíam doença visceral, 51% possuíam expressão de receptores hormonais, 90% haviam recebido tratamento prévio para a doença metastática, sendo 48% previamente expostas a apenas uma linha na doença metastática.
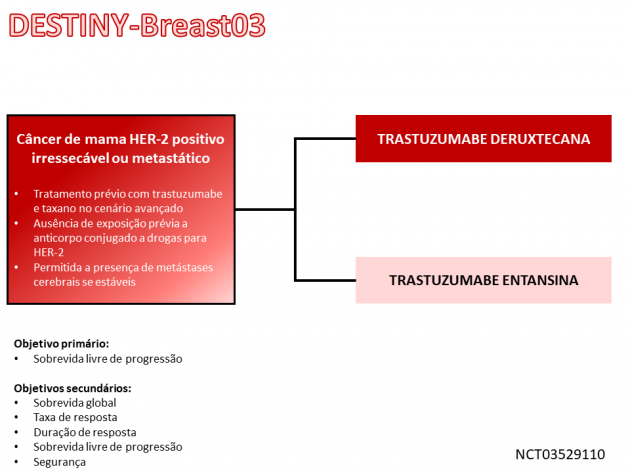
O tratamento com trastuzumabe deruxtecana foi associado a redução de 72% no risco de progressão de doença ou morte, objetivo primário do estudo, em comparação a T-DM1 (HR=0,28; IC de 95%: 0,22-0,37; p<0,001). A análise de sobrevida global ainda é imatura, porém a taxa de sobrevida aos 12 meses foi de 94,1% versus 85,9% para trastuzumabe deruxtecana e T-DM1, respectivamente. A taxa de resposta também foi superior com trastuzumabe deruxtecana (79,7% versus 34,2%), bem como a taxa de respostas completas (16,1% versus 8,7%). Na avaliação de segurança, a taxa de eventos adversos de graus ≥ 3 foi semelhante entre os braços trastuzumabe deruxtecana (52,1%) e T-DM1 (48,3%), sendo náuseas, fadiga e vômito os efeitos adversos mais frequentes no primeiro braço. Destaca-se também a taxa de doença pulmonar intersticial ou pneumonite relacionada à droga, um evento com avaliação adjudicada, que ocorreu em 10,5% dos pacientes tratados com trastuzumabe deruxtecana, sendo 0,8% deles de graus ≥ 3.
Dra. Debora Gagliato, oncologista da BP – A Beneficência Portuguesa de São Paulo, comenta: “de fato, os resultados apresentados no estudo DB03 impressionam, evidenciando redução no risco de progressão ou morte associados ao uso de trastuzumabe deruxtecana em detrimento de T-DM1 em todos os subgrupos de pacientes avaliados, independentemente de linhas anteriores recebidas. O Hazard Ratio para sobrevida livre de progressão foi de 0,28 (P = 7,8 x 10–22), o que é inédito para qualquer tratamento já aprovado em câncer de mama. Adicionalmente, a elaboração de Guidelines para o manejo da doença pulmonar intersticial ajudou a reduzir a incidência desse evento adverso (EA) no estudo DB03. De forma importante, nenhum EA fatal foi relatado nesse importante estudo de fase III, demonstrando uma capacidade substancialmente melhor de identificar e monitorar os pacientes”.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
- [NOTÍCIA] Trastuzumabe deruxtecana recebe designações positivas do FDA
- [NOTÍCIA] Trastuzumabe deruxtecana recebe revisão prioritária para o tratamento de segunda linha do câncer de mama HER-2 positivo avançado pelo FDA
- [NOTÍCIA] Trastuzumabe deruxtecana é aprovado pela ANVISA para o tratamento do câncer de mama HER-2 positivo avançado
- [VÍDEO-MOC] VOLUME 12 ● NÚMERO 12 – TRASTUZUMABE DERUXTECANA EM CÂNCER DE MAMA (ESTUDO DESTINY-BREAST01)
