Continue sua leitura
Cemiplimabe é aprovado para o tratamento do câncer de pulmão de células não pequenas nos EUA
O FDA (Food and Drug Administration) aprovou em 22 de fevereiro de 2021 o anticorpo anti-PD-1 cemiplimabe para o tratamento de primeira linha de pacientes portadores de câncer de pulmão de células não pequenas com alta expressão de PDL-1 (escore tumoral proporcional – TPS ≥ 50%) sem alterações de EGFR, ALK ou ROS1.
“Esta é mais uma aprovação que corrobora o importante papel do bloqueio do eixo PD-1/PDL-1 no tratamento de pacientes com câncer de pulmão de células não pequenas metastático com alta expressão de PDL-1. Cemiplimabe passa então a ser mais uma nova opção de tratamento padrão neste cenário”, destaca o Dr. William William, oncologista e diretor médico da Oncologia Clínica e Hematologia do Centro Oncológico da BP – A Beneficência Portuguesa de São Paulo.
A aprovação é baseada no estudo de fase III EMPOWER-Lung 1, que randomizou 710 pacientes com câncer de pulmão de células não pequenas avançado para receber cemiplimabe ou quimioterapia baseada em platina como terapia de primeira linha.
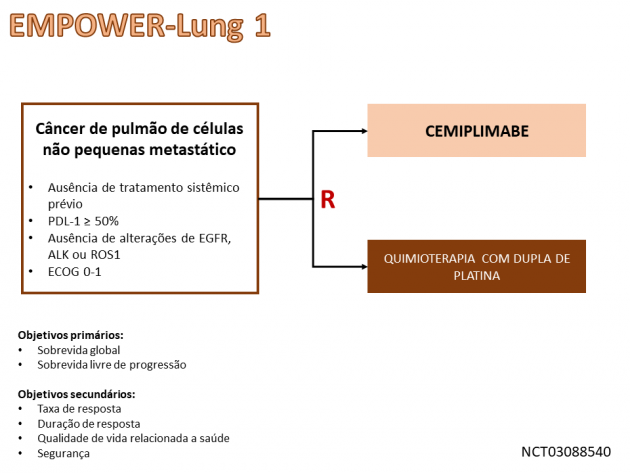
O tratamento com o imunoterápico reduziu em 32% o risco de morte em comparação a quimioterapia, objetivo coprimário do estudo, com sobrevidas medianas de 22,1 versus 14,3 meses (HR=0,68; IC de 95%: 0,53-0,87; p=0,0022). A sobrevida livre de progressão, outro desfecho coprimário, também favoreceu o tratamento com o imunoterápico (HR=0,59; IC de 95%: 0,49-0,72; p<0,0001). Dentre os demais objetivos, a taxa de resposta também foi superior no braço cemiplimabe (37% versus 21%). Os eventos adversos mais frequentes no braço do imunoterápico foram dor musculoesquelética, rash cutâneo, fadiga, redução do apetite, pneumonia e tosse.
A dose recomendada de tratamento é cemiplimabe, 350 mg via intravenosa, a cada 3 semanas.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
