Continue sua leitura
ANVISA concede aprovação inovadora para anticorpo conjugado a droga no tratamento do carcinoma urotelial avançado
A ANVISA (Agência Nacional de Vigilância Sanitária) aprovou em 23 de maio de 2022 o anticorpo conjugado a droga (ADC) enfortumabe vedotina para o tratamento de pacientes com carcinoma urotelial localmente avançado ou metastático previamente tratados com quimioterapia baseada em platina e inibidor de checkpoint, além de pacientes inelegíveis a cisplatina que receberam ao menos uma linha de tratamento sistêmico prévia.
Os dados utilizados para a análise desta indicação terapêutica derivam do estudo de fase III EV-301, que randomizou 608 pacientes com carcinoma urotelial avançado previamente tratados com quimioterapia baseada em platina e imunoterapia entre enfortumabe vedotina ou quimioterapia a escolha do investigador (docetaxel, paclitaxel ou vinflunina). Dentre a população incluída no estudo, 19,7% dos pacientes possuíam idade igual ou superior a 75 anos, 33,7% da população possuía tumor primário no trato urinário superior, 30,9% possuíam metástases hepáticas e 12,5% dos pacientes haviam recebido ao menos 3 linhas de tratamento sistêmico.
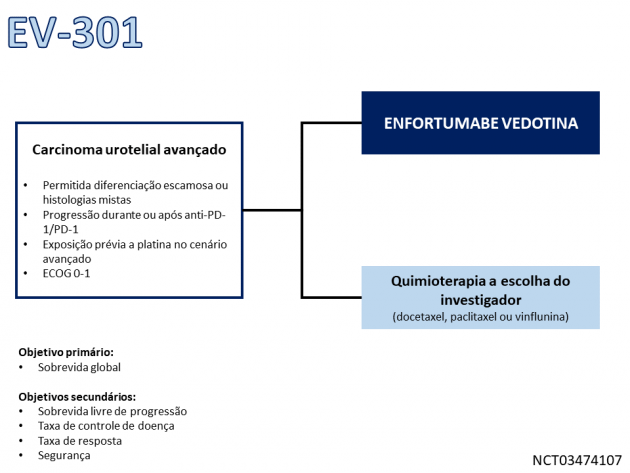
A sobrevida global, objetivo primário do estudo, foi de 12,9 versus 9,0 meses para os braços enfortumabe e quimioterapia, respectivamente (HR=0,70; IC de 95%: 0,56-0,89; p=0,0014). O tratamento com o ADC também reduziu em 38% o risco de progressão de doença ou morte (medianas de 5,6 versus 3,7 meses; HR=0,62; IC de 95%: 0,51-0,75; p<0,0001). A taxa de resposta novamente foi superior no braço de enfortumabe (40,6% versus 17,9%; p<0,0001). Em uma análise apresentada no congresso da ESMO (European Society of Medical Oncology) 2021, o tratamento com enfortumabe demonstrou benefício em sobrevida global mesmo em subgrupos de pacientes de maior risco, como aqueles com idade ≥ 65 anos, portadores de metástases hepáticas, com tumores primários do trato urinário superior e em pacientes que não tiveram resposta ao tratamento prévio com imunoterapia.
A aprovação do tratamento de pacientes inelegíveis a cisplatina se baseou nos dados do estudo de fase II EV-201. A taxa de resposta a enfortumabe nesta população foi de 51%, com 22% de respostas completas e duração mediana do benefício de 13,8 meses.
A taxa de eventos adversos relacionados ao tratamento de graus ≥ 3 foi de 51,4% no braço enfortumabe, sendo os principais eventos adversos nesta graduação: rash cutâneo, fadiga, e neutropenia.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
