Continue sua leitura
Atezolizumabe monoterapia aprovado para o tratamento de primeira linha do câncer de pulmão de células não pequenas no Brasil
A ANVISA (Agência Nacional de Vigilância Sanitária) aprovou em 11 de janeiro de 2021 o uso do anticorpo monoclonal anti-PDL-1 atezolizumabe para o tratamento de primeira linha de pacientes com câncer de pulmão de células não pequenas metastático com alta expressão de PDL-1 (≥ 50% nas células tumorais ou ≥ 10% nas células imunes) sem mutações de sensibilidade do EGFR ou ALK.
“A aprovação solidifica o papel da imunoterapia com agente único em pacientes selecionados com alta expressão de PDL-1, e atezolizumabe é mais uma nova opção padrão nesse contexto”, comenta o Dr. William William, oncologista e diretor médico da Oncologia Clínica e Hematologia do Centro Oncológico da BP – A Beneficência Portuguesa de São Paulo.
Os resultados que motivaram a aprovação são derivados do estudo de fase III IMpower110, que randomizou 572 pacientes com câncer de pulmão de células não pequenas com expressão de PDL-1 ≥ 1% entre atezolizumabe ou quimioterapia (dupla de platina com pemetrexede ou gencitabina se histologia não escamosa ou escamosa, respectivamente).
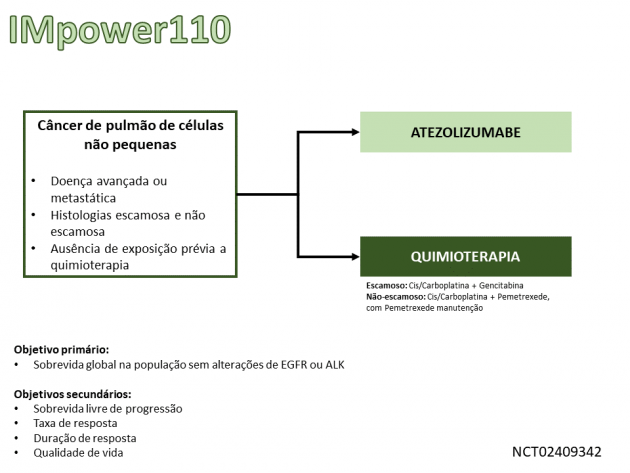
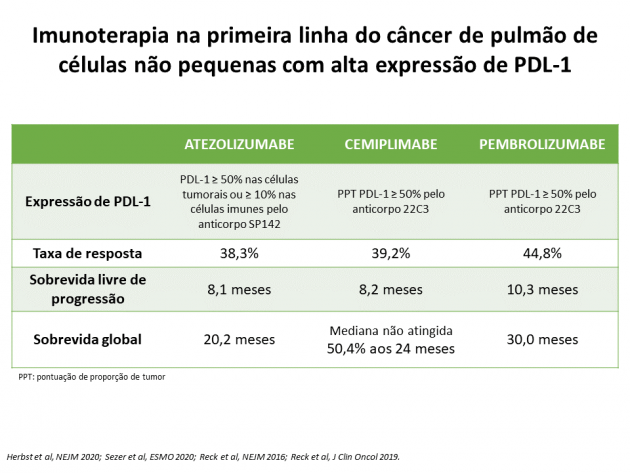
A sobrevida global, desfecho primário do estudo, foi avaliada de maneira hierárquica de acordo com os níveis de expressão de PDL-1. Na população com PDL-1 ≥ 50% nas células tumorais ou ≥ 10% nas células imunes, a sobrevida global mediana foi de 20,2 versus 13,1 meses nos braços atezolizumabe e quimioterapia, respectivamente (HR=0,59; IC de 95%: 0,40-0,89; p=0,0106).
A sobrevida livre de progressão também foi superior no braço atezolizumabe (medianas de 8,1 versus 5,0 meses; HR=0,63; IC de 95%: 0,45-0,88), assim como a taxa de resposta (38,3% versus 28,6%) e a duração mediana de resposta (não atingida para atezolizumabe versus 6,7 meses para o braço quimioterapia). O perfil de eventos adversos foi semelhante ao uso de atezolizumabe em outras indicações.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
