Continue sua leitura
Combinação de nivolumabe e ipilimumabe é aprovada para o tratamento do mesotelioma pleural nos EUA
O FDA (Food and Drug Administration) aprovou em 02 de outubro de 2020 a combinação dos anticorpos anti-PD-1 nivolumabe e anti-CTLA4 ipilimumabe para o tratamento de primeira linha de pacientes portadores de mesotelioma pleural irressecável, baseado nos dados de eficácia do estudo de fase III CheckMate743.
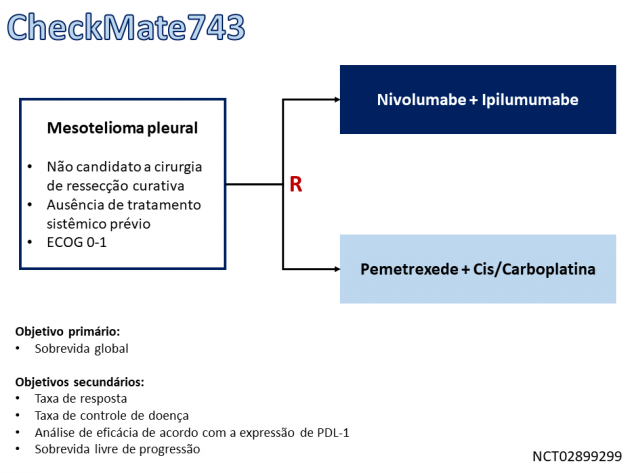
Nesse estudo, 606 pacientes com mesotelioma pleural irressecável foram randomizados entre tratamento de primeira linha com a combinação de nivolumabe e ipilimumabe administrada por até 2 anos ou 6 ciclos de quimioterapia com pemetrexede associado uma platina (cisplatina ou carboplatina). Com um seguimento mediano de 29,7 meses, o estudo atingiu seu objetivo primário, demonstrando que a combinação de nivolumabe e ipilimumabe reduziu em 26% o risco de morte quando comparado a quimioterapia (medianas de 18,1 versus 14,1 meses; HR=0,74; IC de 95%: 0,61-0,89; p=0,002). A sobrevida livre de progressão mediana foi 6,8 versus 7,2 meses (HR=1,0; IC de 95%: 0,81-1,21) com os imunoterápicos e a dupla de platina, respectivamente. A taxa de resposta foi semelhante entre os grupos (40% versus 43%), entretanto a duração mediana de resposta foi superior no braço de imunoterapia (11,0 versus 6,7 meses).
Dentre a análise de segurança, os eventos adversos mais comuns nos pacientes que receberam nivolumabe e ipilimumabe foram fadiga, dor musculoesquelética, rash, diarreia, dispneia, náusea, redução do apetite, tosse e prurido.
As doses recomendadas para essa indicação de tratamento são nivolumabe 360 mg intravenoso (IV) a cada 3 semanas e ipilimumabe 1 mg/kg IV a cada 6 semanas, ambos administrados por um período máximo de 2 anos ou até progressão de doença ou toxicidade limitante.
Destaca-se que a revisão dos dados que motivou a aprovação pelo FDA foi conduzida através do Projeto Orbis, uma parceria colaborativa entre agências regulatórias internacionais de diferentes países (Estados Unidos, Austrália, Brasil, Canadá e Suíça) que visa agilizar as análises para aprovação de tratamentos oncológicos entre os países que compõe a parceria.
Por Dr. Daniel Vargas P. de Almeida
