Continue sua leitura
Tratamento adjuvante com alectinibe recebe aprovação nos EUA
No dia 18 de abril de 2024, o FDA (Food and Drug Administration) concedeu aprovação a alectinibe como terapia adjuvante pós-operatória em pacientes com câncer de pulmão de células não pequenas (CPCNP) ALK positivo.
O uso de alectinibe neste cenário foi avaliado no estudo de fase III ALINA, que incluiu pacientes com CPCNP ressecável nos estágios IB (tumores ≥ 4 cm) a IIIA (segundo a 7ª edição da AJCC) com rearranjos de ALK. Um total de 257 pacientes foram randomizados a uma razão 1:1 para receber alectinibe ou quimioterapia baseada em platina após a cirurgia. A idade mediana da população foi de 56 anos, 24% tinham ≥ 65 anos, 52% eram mulheres, 56% eram asiáticos, 60% nunca haviam fumado, 10% se apresentavam em estágio IB, 35% no estágio II e 55% no estágio IIIA da doença.
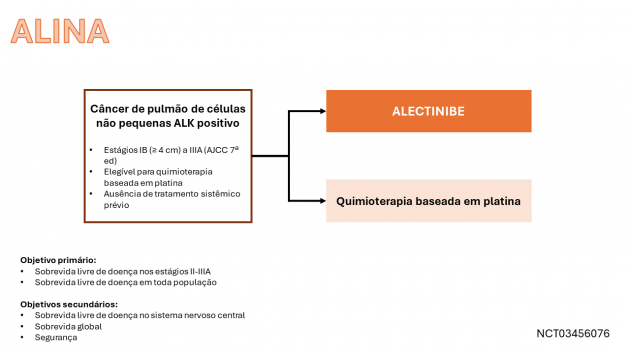
Nos pacientes com CPCNP estágios II a IIIA, a sobrevida livre de doença mediana não foi alcançada no braço de alectinibe e foi de 44,4 meses no braço de quimioterapia (HR=0,24; IC de 95%: 0,13-0,45; p < 0,0001). Resultados similares foram observados na população geral do estudo, com mediana também não alcançada no braço do alectinibe e 41,3 meses no braço da quimioterapia (HR=0,24; IC de 95%: 0,13-0,43; p < 0,0001). Em análise exploratória sobre o acometimento cerebral como sítio de recorrência, esta apresentação ocorreu em 3,1% dos pacientes que receberam alectinibe e 11% no braço de quimioterapia. Na avaliação de segurança, os eventos adversos mais comuns (≥ 20%) em pacientes tratados com alectinibe incluíram: hepatotoxicidade, constipação, mialgia, COVID-19, fadiga, rash e tosse.
Por Dr. Daniel Vargas P. de Almeida
