Continue sua leitura
Testes de sensibilidade ao tratamento do câncer: como os organoides derivados de pacientes podem mudar a oncologia
A identificação de métodos capazes de predizer, de forma individualizada, a resposta ao tratamento oncológico sistêmico permanece um desafio relevante na prática clínica. Apesar dos avanços obtidos com a incorporação de biomarcadores moleculares e genômicos, a maior parte dos esquemas quimioterápicos e uma parcela significativa das terapias-alvo continuam a ser prescritas com base em benefícios populacionais, sem instrumentos confiáveis para antecipar o benefício clínico em nível individual. Como consequência, observa-se ampla variabilidade de resposta entre pacientes com tumores biologicamente semelhantes, além de exposição frequente a tratamentos sem benefício e com toxicidade relevante (1).
Nesse contexto, os testes funcionais de sensibilidade ao tratamento baseados em organoides derivados do paciente (patient-derived organoids, PDOs) permitem a avaliação direta da sensibilidade tumoral ex vivo à quimioterapia, às terapias-alvo e, em plataformas mais avançadas, à imunoterapia. O objetivo dessa estratégia é aprimorar a seleção terapêutica, especialmente em cenários nos quais a genômica se mostra insuficiente ou inconclusiva (2).
Na prática, já existem serviços comerciais baseados em cultura tridimensional ex vivo que disponibilizam relatórios funcionais para oncologistas. Entre os exemplos mais citados estão o PARIS® Test (SEngine Precision Medicine, EUA) (3) e a plataforma 3D Predict™ (Kiyatec, EUA) (4), ambos certificados segundo o CLIA (Clinical Laboratory Improvement Amendments) e o Onco-PDO® (Invitrocue, Singapura) (5), todos ensaios funcionais baseados em organoides derivados de pacientes para avaliação de sensibilidade e resistência a terapias antineoplásicas ex vivo. É importante ressaltar que a certificação CLIA se refere à qualidade analítica do laboratório e não equivale à aprovação regulatória do teste como dispositivo diagnóstico pelo FDA.
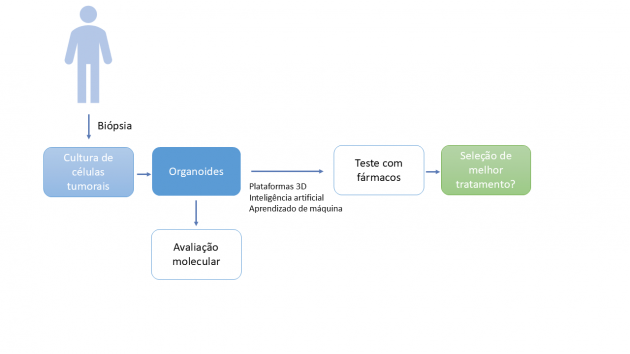
Como funciona o exame
De modo geral, os testes funcionais baseados em organoides derivados de pacientes (PDOs) utilizam amostras tumorais viáveis para gerar culturas tridimensionais representativas do tumor de origem, que são então expostas de forma padronizada a agentes antineoplásicos, isolados ou em combinação. A resposta é mensurada por leituras quantitativas, incluindo viabilidade celular e parâmetros de crescimento tumoral, como growth rate (GR), área sob a curva (AUC) e IC50, resultando em um perfil funcional de sensibilidade e resistência terapêutica, cuja interpretação depende de padronização técnica rigorosa para assegurar reprodutibilidade e potencial validade clínica (6).
Além dos modelos clássicos de organoides epiteliais, plataformas que incorporam componentes do microambiente tumoral, como co-culturas com fibroblastos ou células imunes vem ganhando relevância. Essas abordagens buscam capturar fenômenos determinantes da resposta a terapias-alvo e imunoterapias, incluindo evasão imune e dependência estromal (6).
Eficácia do método e concordância com a prática clínica
A evidência clínica mais frequentemente citada em suporte à validade dos testes funcionais baseados em organoides derivados de pacientes (PDOs) provém de coortes clínicas nas quais os resultados ex vivo são correlacionados diretamente com os desfechos clínicos observados. No contexto de tumores gastrointestinais metastáticos, um estudo fundamental publicado na revista Science demonstrou alto desempenho preditivo na avaliação de resposta à quimioterapia e a terapias-alvo, com sensibilidade de 100%, especificidade de 93%, valor preditivo positivo de 88% e valor preditivo negativo de 100% para resposta clínica, evidenciando associação estatisticamente significativa entre a resposta ex vivo e o comportamento tumoral in vivo (7).
Nesse mesmo trabalho, foram documentados exemplos claros de heterogeneidade inter e intrapaciente. No tratamento com TAS-102, PDOs derivados de diferentes sítios metastáticos apresentaram padrões distintos de sensibilidade ex vivo em pacientes com estabilidade versus progressão da doença (7).
Revisões recentes que sintetizam estudos por tipo tumoral também reportam desempenhos relevantes em outros cenários. Em câncer de pulmão, por exemplo, foram descritas sensibilidade de 84,0% e especificidade de 82,8% em uma coorte analisada. Em câncer de mama, dados agregados indicam sensibilidade de 82,35%, especificidade de 69,23% e acurácia de 76,67%. Embora esses valores variem conforme a plataforma, os critérios de definição de resposta e os regimes terapêuticos avaliados, eles sustentam a existência de um sinal consistente de correlação clínica em diferentes contextos oncológicos (6).
Evidências recentes com uso de PDOs
No câncer gástrico, uma coorte de 73 pacientes demonstrou que o teste funcional baseado em PDOs atingiu taxa de concordância de 91,7% entre o resultado do ensaio ex vivo e a resposta clínica à quimioterapia. Esse dado é particularmente relevante em um tumor caracterizado por grande heterogeneidade biológica e ampla variabilidade de resposta terapêutica, no qual a escolha inadequada da primeira linha pode ter impacto clínico significativo (6).
No adenocarcinoma ductal pancreático, duas evidências merecem destaque. Em um estudo envolvendo 31 pacientes, o teste funcional com PDOs permitiu a estratificação dos doentes em grupos classificados como sensíveis, intermediários ou resistentes, com diferenças estatisticamente significativas em sobrevida livre de progressão entre os grupos. Essa abordagem fornece uma tradução clínica direta do resultado funcional em termos de risco e benefício terapêutico esperado (6).
Uso de PDOs para predizer resposta a terapias-alvo e imunoterapia
A ampliação dos testes funcionais além da quimioterapia pode explicar discordâncias entre biomarcadores moleculares e resposta clínica. Como exemplo, estudos com paciente com amplificação de EGFR e status selvagem de KRAS e BRAF, perfil classicamente associado à sensibilidade a terapias anti-EGFR, apresentou progressão clínica sob cetuximabe, enquanto os PDOs derivados desse tumor demonstraram resistência ex vivo, sugerindo que, em cenários específicos, o fenótipo funcional pode capturar mecanismos de resistência não previstos pela caracterização genômica isolada (7).
No contexto da imunoterapia, modelos de organoides que preservam componentes do microambiente tumoral podem ser úteis para investigar respostas ao bloqueio de checkpoints imunológicos. Em culturas organotípicas derivadas de melanoma metastático co-cultivadas com linfócitos T, observou-se que PDOs de pacientes que responderam a bloqueadores de PD-1 (nivolumabe) ex vivo exibiram expansão rápida de células T e ativação funcional, enquanto aqueles derivados de tumores resistentes não o fizeram, sugerindo que esses modelos podem capturar diferenças funcionais associadas à resposta clínica ao tratamento com imunoterapia (8).
Desafios e próximos passos
Atualmente, os testes funcionais baseados em organoides derivados de pacientes devem ser encarados como ferramentas complementares à decisão clínica, ainda restritas a contextos selecionados, como protocolos de pesquisa ou cenários de falha terapêutica na ausência de biomarcadores preditivos validados. Persistem desafios relevantes, incluindo padronização metodológica, tempo e taxa de estabelecimento dos organoides e incorporação do microambiente tumoral. Ainda assim, evidências emergentes apresentadas em congressos como ASCO 2025, ESMO 2025 e SABCS 2025 (9–11) indicam que a consolidação do campo dependerá de estudos prospectivos capazes de demonstrar impacto clínico reprodutível.
Por Dr. Caio Leite
Referências:
- Tong L, et al. Med. 2024;5:135
- Su C, et al. Cancers. 2023;15:805.
- Paris Test. 16 Dec 2025. Disponível em: https://senginemedicine.com/paris-test
- 3D Predict. 16 Dec 2025. Disponível em: https://kiyatec.com/healthcare-professionals/3d-predict-platform/
- Onco-PDO. 16 Dec 2025. Disponível em: https://www.invitrocue.com/oncology/onco-pdo/
- Wang Q, et al. Cell Death Discov. 2025;11(1):222.
- Vlachogiannis G, et al. Science. 2018;359(6378):920.
- Kaminska K, et al. PREPRINT (Version 1) available at Research Square [https://doi.org/10.21203/rs.3.rs-7486809/v1]
- Lee JY, et al. J Clin Oncol. 43:16_suppl, e15102.
- Vaccarella S, et al. ESMO Open, 2025 10: 105135.
- Costa ET, et al. SABCS 2025. PS4-02-05.
