Continue sua leitura
Terapia oral aprovada para tumor ósseo e articular raro nos EUA
Os tumores tenossinoviais de células gigantes são um grupo de neoplasias raras. Como tal, os registros de epidemiológicos são escassos nessa patologia, entretanto os dados disponíveis demonstram que a idade mediana da apresentação varia entre 30-50 anos (dentre os diferentes subtipos), e há um maior acometimento na população do sexo feminino. O emprego da cirurgia é considerado o tratamento padrão na maioria dos casos, porém o procedimento por vezes é associado a limitação funcional e morbidade importantes quando empregado na doença localmente avançada e recidivada. Em 02 de agosto, o FDA (Food and Drug Administration) anunciou a aprovação de pexidartinibe, um inibidor de tirosina quinase oral dirigido para CSF1R, KIT e FLT3, no tratamento dos tumores tenossinoviais de células gigantes sintomáticos não candidatos a tratamento cirúrgico, ou com expectativa de morbidade exacerbada com a abordagem cirúrgica.
A avaliação dessa droga foi realizada através do estudo de fase III ENLIVEN que randomizou 120 pacientes para receber tratamento com pexidartinibe ou placebo. Cerca de um terço dos pacientes em ambos os braços de tratamento já haviam sido submetidos a ≥ 2 procedimentos cirúrgicos para a doença. Após uma análise preliminar, realizada pelo comitê de monitorização dos dados de segurança, a inclusão de pacientes no estudo foi encerrada antes do prazo previsto inicialmente, devido a ocorrência de disfunção hepática grave como evento adverso em dois pacientes. Por conta destes eventos, o FDA incluiu um alerta (boxed warning) alertando pacientes e profissionais de saúde pelo risco potencialmente fatal por complicações hepáticas.
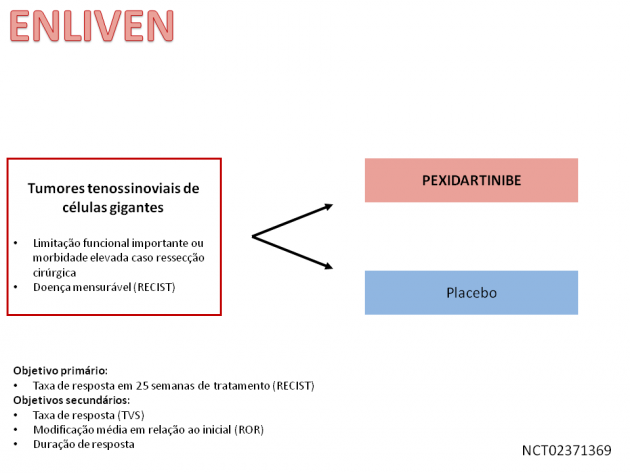
O estudo atingiu seu desfecho primário: taxa de resposta após 25 semanas de tratamento. O grupo tratado com pexidartinibe, neste momento, teve 39% de resposta (15% de resposta completas), ao passo que nenhum paciente do grupo que recebeu placebo teve resposta. A taxa de resposta global foi de 53%. Após 6 meses de seguimento, nenhum paciente que atingiu resposta apresentou progressão e, com seguimento mediano de 22 meses, a duração mediana do benefício não foi atingida.
Eventos adversos de graus 3 e 4 ocorreram em 44% dos pacientes tratados com pexidartinibe. Dentre os eventos mais comuns, destacam-se elevação de transaminases hepáticas e fosfatase alcalina, hipertensão e despigmentação de cabelos.
Por Dr. Daniel Vargas P. de Almeida
