Continue sua leitura
Terapia inovadora é aprovada para o tratamento do câncer de mama RH positivo nos EUA
O FDA (Food and Drug Administration) aprovou no dia 27 de janeiro de 2023 o uso do antagonista de receptor de estrogênio elacestranto para o tratamento de pacientes pós-menopáusicas com câncer de mama metastático com expressão positiva de receptor de estrogênio (RE+), HER-2 negativo e com mutação de ESR1 após progressão a pelo menos uma linha de terapia hormonal.
A eficácia de elacestranto foi avaliada no estudo de fase III EMERALD que randomizou 478 pacientes com câncer de mama metastático na pós-menopausa RE+, HER-2 negativo entre o antagonista de receptor estrogênico ou terapia hormonal à escolha do investigador (fulvestranto ou um inibidor da aromatase). Para a inclusão no estudo era necessária exposição prévia a uma ou duas linhas de terapia hormonal para a doença avançada, incluindo uma linha com inibidor de CDK4/6. O status de mutação do ESR1 foi determinado através de teste de DNA tumoral circulante pela plataforma Guardant360 e limitado a mutações missense no domínio de ligante (localizado entre os códons 310 e 547). Na coorte do estudo, mutação em ESR1 foi detectada em 228 pacientes (47,8%), dentre o quais a idade mediana foi 63 anos, 71% possuíam metástases viscerais, 39% haviam recebido duas linhas de tratamento prévias, sendo que 25% haviam sido previamente expostas a quimioterapia para a doença avançada.
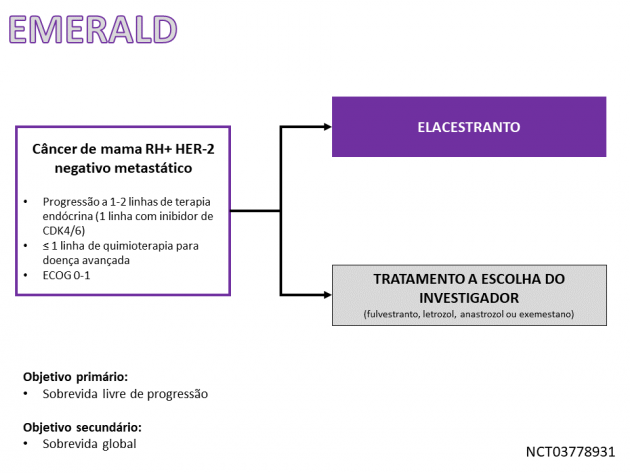
Como resultados do estudo, a sobrevida livre de progressão favoreceu o braço tratado com elacestranto na análise da população global (HR=0,70; IC de 95%: 0,55-0,88; p=0,002). Nas pacientes com mutação de ESR1, o uso de elacestranto também demonstrou resultado positivo na análise de sobrevida livre de progressão (HR=0,55; IC de 95%: 0,39-0,77; p=0,0005). Os dados de sobrevida global ainda são imaturos. Os eventos adversos mais frequentes no tratamento com elacestranto foram dor musculoesquelética, náuseas, elevação de colesterol, elevação de transaminases, elevação de triglicérides, fadiga, anemia, vômitos, hiponatremia, elevação de creatinina, redução do apetite, diarreia, cefaleia, constipação, dor abdominal, fogachos e dispepsia.
A Dra. Debora Gagliato, oncologista da BP – A Beneficência Portuguesa de São Paulo, comenta: “A análise atualizada do estudo de fase III EMERALD, apresentada no San Antonio Breast Cancer Symposium, demonstrou que uma duração mais longa de tratamento em linha prévia com inibidor de CDK4/6 se correlacionou com sobrevida livre de progressão mais robusta no braço elacestranto em comparação com o tratamento padrão. Adicionalmente, o benefício foi mais evidente em pacientes portadores de mutação no gene ESR1. Naqueles com uso prévio de inibidor de CDK4/6 por pelo menos 12 meses e mutação de ESR1, foi alcançada uma sobrevida livre de progressão mediana de 8,6 meses com elacestranto versus 1,9 meses com tratamento padrão (HR=0,41). Há um ponto importante a ser destacado: a medicação deve trazer uma comodidade posológica importante para os pacientes, uma vez que são substituídas 2 injeções intramusculares a cada 28 dias (no caso de fulvestranto) por 1 comprimido via oral.
EMERALD é o primeiro estudo de fase III a demonstrar um ganho significativo em sobrevida livre de progressão de um degradador seletivo do receptor estrogênico (SERD) oral versus terapia endócrina convencional em pacientes com câncer de mama metastático RH positivo e HER-2 negativo com 1 ou 2 linhas anteriores de tratamento endócrino prévio e até uma linha de quimioterapia prévia, trazendo uma nova opção de terapia endócrina para os pacientes”.
Por Dr. Daniel Vargas P. de Almeida
