Continue sua leitura
Primeiro tratamento direcionado a tumores com alterações no gene RET é aprovado nos EUA
Análises de banco de dados com tumores de diferentes sítios primários demonstram que as alterações no gene RET estão presentes em aproximadamente 2% de todas as neoplasias, quando analisadas globalmente. Entretanto, a frequência dessas alterações varia de acordo com o sítio de origem da doença, como exemplos, a prevalência no carcinoma medular da tireoide é de 63%, nos carcinomas bem diferenciados de tireoide é de 10%, e no câncer de pulmão de células não pequenas a prevalência é aproximadamente 3%.
No dia 8 de maio de 2020, o FDA (Food and Drug Administration) anunciou a aprovação acelerada de selpercatinibe, um inibidor de quinase do RET de administração oral, para diferentes indicações de tratamento:
- Pacientes adultos com câncer de pulmão de células não pequenas metastático com fusão de RET;
- Pacientes adultos e pediátricos (≥ 12 anos) portadores de carcinoma medular de tireoide com mutação de RET;
- Pacientes adultos e pediátricos (≥ 12 anos) com câncer de tireoide avançado ou metastático com fusão de RET refratários a radioiodoterapia.
Os dados que motivaram a aprovação nessas diferentes indicações são resultantes do estudo de fase I/II LIBRETTO-001, que avaliou o uso de selpercatinibe no tratamento de tumores de diferentes sítios primários com alterações do gene RET detectadas através de diferentes métodos (NGS, PCR ou FISH). O objetivo primário do estudo foi avaliação da taxa de resposta analisada por um comitê revisor independente.
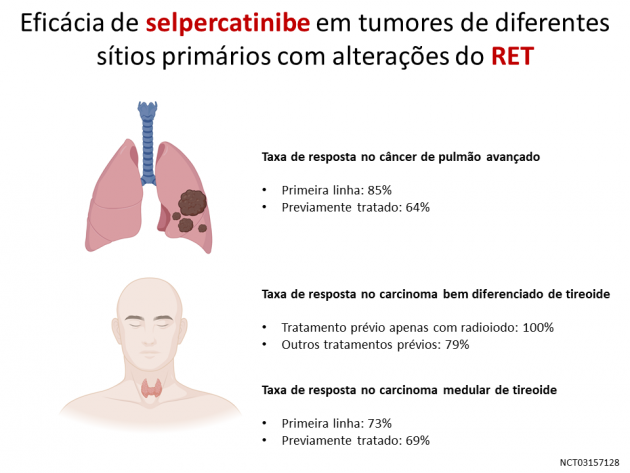
Dentre os pacientes com câncer de pulmão de células não pequenas a taxa de resposta foi 64% naqueles previamente tratados com quimioterapia baseada em platina, e de 85% dentre os pacientes sem história de tratamento prévio.
Nos pacientes portadores de carcinoma medular de tireoide, a taxa de resposta foi 69% nos pacientes previamente tratados com cabozantinibe ou vandetanibe, e 73% naqueles sem tratamento prévio com as drogas.
Já nos pacientes com carcinomas bem diferenciados de tireoide, a taxa de resposta foi 79% naqueles com exposição previa a diferentes tratamentos sistêmicos e 100% nos pacientes tratados previamente apenas com radioiodo.
Na avaliação de segurança, os efeitos adversos mais comuns foram elevação de transaminases, hiperglicemia, leucopenia, hipoalbuminemia, hipocalcemia, xerostomia, diarreia, elevação de creatinina, elevação de fosfatase alcalina, hipertensão arterial, fadiga, edema periférico, plaquetopenia, hipercolesterolemia, rash cutâneo, constipação e hiponatremia.
Por Dr. Daniel Vargas P. de Almeida
