Continue sua leitura
Primeiro inibidor de PI3K aprovado para o tratamento do câncer de mama nos EUA
A via do PI3K-AKT-mTOR é um importante mecanismo regulador do crescimento e metabolismo celular. As mutações no gene PIK3CA ocorrem em até 40% dos tumores de mama RH positivos, possuindo um papel de importância no mecanismo de resistência a terapia endócrina no câncer de mama. Diante desse cenário, o FDA (Food and Drug Administration) aprovou em 23 de maio de 2019 o tratamento do câncer de mama metastático/localmente avançado RH positivo com o inibidor de PI3K alpelisib em pacientes com mutação do PIK3CA após progressão a terapia hormonal.
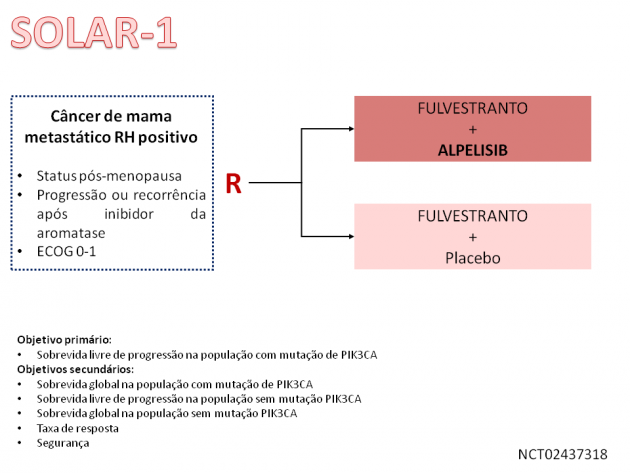
Essa terapia foi avaliada no estudo de fase III SOLAR-1, que randomizou 572 pacientes com câncer de mama metastático RH positivo HER-2 negativo com progressão a terapia endócrina com inibidor da aromatase para receberem fulvestranto associado a alpelisib ou a placebo. Foi permitida a inclusão de pacientes com resistência primária a terapia hormonal (recorrência em menos de 24 meses do início de terapia hormonal adjuvante, ou progressão em menos de 6 meses do início da terapia hormonal de primeira linha), bem como aqueles com resistência secundária (recorrência após mais de 24 meses do início de terapia hormonal adjuvante, recorrência em menos de 12 meses após o fim da terapia hormonal adjuvante, ou progressão após mais de 6 meses do início de terapia hormonal de primeira linha). A análise dos resultados na população com mutação de PIK3CA, após um seguimento mediano de 20 meses, demonstrou benefício em sobrevida livre de progressão (HR=0,65; IC de 95%: 0,50-0,85; p<0,001), além de maior taxa de resposta (26,6% versus 12,8%) para os pacientes tratados com alpelisib. Os dados de sobrevida global ainda não são maduros nesta análise. O tratamento com alpelisib na coorte de pacientes com ausência de mutação do PIK3CA não foi capaz de demonstrar benefício em sobrevida livre de progressão. Dentre as análises de segurança, o tratamento com o inibidor de PI3K promoveu uma taxa de eventos adversos de graus igual ou maior a 3 de 76%, destacando-se hiperglicemia, toxicidades gastrointestinais (náusea, vômito e diarreia), além de fadiga.
Adicionalmente à aprovação do medicamento, o FDA também aprovou o teste diagnóstico PIK3CA RGQ PCR Kit, que permite detectar a mutação em amostras de tecido e biópsia líquida, facilitando a seleção dos pacientes candidatos ao tratamento com alpelisib.
“O inibidor de PI3K alpelisib surge como uma importante opção terapêutica para pacientes com câncer de mama metastático RH positivo com um alvo específico, mas bem comum nesse grupo de pacientes. Ao contrário de outras medicações dessa classe previamente testadas, que possuíam toxicidade limitante para seu uso rotineiro, essa nova medicação possui perfil de efeitos colaterais manejáveis e com significativo benefício clínico, dessa forma prolongando o tempo de uso de hormonioterapia sem necessidade de início de tratamento quimioterápico. O próximo passo será definir algoritmos de tratamento para as pacientes com câncer de mama RH positivo HER-2 negativo diante das novas classes de medicações atualmente disponíveis para tratamento dessa doença”, enfatiza a Dra. Juliana Martins Pimenta, oncologista da BP – A Beneficência Portuguesa de São Paulo.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
