Continue sua leitura
Primeiro combo aprovado para o câncer de próstata metastático resistente à castração no Brasil
A ANVISA (Agência Nacional de Vigilância Sanitária) aprovou em 23 de janeiro de 2023 a combinação de olaparibe e abiraterona para o tratamento de primeira linha de pacientes com câncer de próstata metastático resistente à castração (CPRCm) independente do status mutacional.
O combo foi avaliado neste cenário no estudo de fase III PROpel, que randomizou 796 pacientes entre tratamento de primeira linha do CPRCm com olaparibe e abiraterona ou abiraterona. Dentre os critérios de inclusão do estudo, foi permitida exposição prévia a docetaxel, desde que no cenário neoadjuvante/adjuvante ou metastático sensível a castração. Tratamento com um agente hormonal de nova geração era permitido (exceto abiraterona), desde que o intervalo entre o término do tratamento e a randomização fosse ≥ 12 meses. Dentre a população incluída, cerca de 20% haviam recebido docetaxel no cenário castração-sensível, apenas 1 paciente havia recebido tratamento com um novo agente anti-hormonal e cerca de 70% dos pacientes não apresentavam mutação nos genes relacionados ao reparo por recombinação homóloga (HRR).
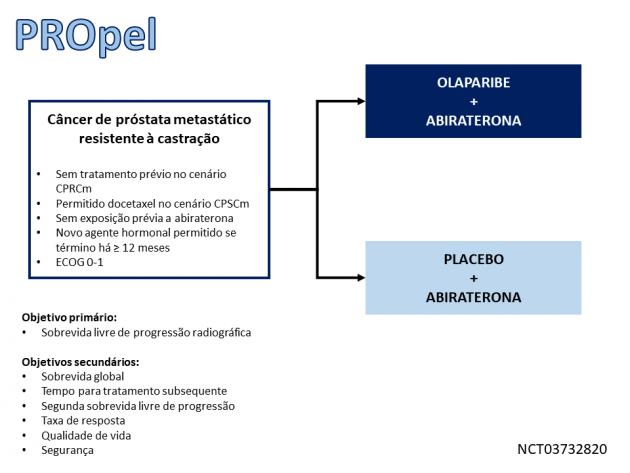
O estudo atingiu seu objetivo primário, demonstrando que a combinação de olaparibe e abiraterona resultou em sobrevida livre de progressão radiográfica mediana de 24,8 meses versus 16,6 meses com abiraterona (HR=0,66; IC de 95%: 0,54-0,81; p<0,001). Na análise exploratória de subgrupos, o tratamento combinado sugeriu ser benéfico tanto nos pacientes com mutação de HRR (HR=0,50; IC de 95%: 0,34-0,73) quanto naqueles sem mutação (HR=0,76; IC de 95%: 0,60-0,97).
A análise de sobrevida global ainda tem dados imaturos, porém o combo foi superior nas avaliações de tempo para tratamento subsequente (HR=0,74; IC de 95%: 0,61-0,90) e segunda sobrevida livre de progressão (HR=0,69; IC de 95%: 0,51-0,94), além de também apresentar taxa de resposta objetiva superior (58,4% versus 48,1%). A taxa de eventos adversos de graus ≥ 3 no braço experimental foi 47,2%, com taxa de descontinuação por eventos adversos de 13,8%. Os eventos adversos apresentados em maior frequência foram: anemia, fadiga, náuseas, diarreia e constipação.
Por Dr. Daniel Vargas P. de Almeida
