Continue sua leitura
Primeira terapia específica aprovada para o câncer de pulmão com alteração do MET nos EUA
O tratamento do câncer de pulmão de células não pequenas avançado é uma das áreas de maior avanço na oncologia de precisão, com a incorporação de diferentes testes para definição de tratamento, tanto considerando o emprego de imunoterapia quanto o uso de terapias-alvo. As alterações no gene MET estão presentes em aproximadamente 3-4% dos adenocarcinomas de pulmão e apresentam-se como uma alteração driver, sendo, portanto, um alvo terapêutico nessa doença. No dia 05 de maio de 2020, o FDA (Food and Drug Administration) concedeu aprovação acelerada ao inibidor seletivo de MET capmatinibe para o tratamento de pacientes com câncer de pulmão de células não pequenas metastático com mutação do tipo skipping no éxon 14 do MET.
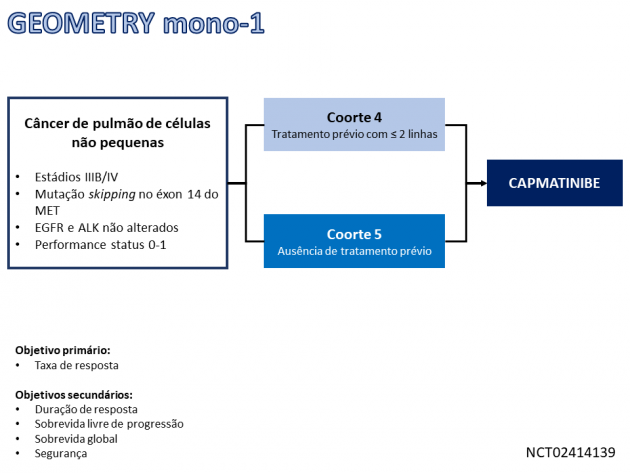
A aprovação é baseada nos dados do estudo de fase II GEOMETRY mono-1, que avaliou o uso de capmatinibe no tratamento de 97 pacientes com câncer de pulmão de células não pequenas metastático com alterações skipping no éxon 14 do MET em duas diferentes coortes. A taxa de resposta foi de 68% dentre os 28 pacientes sem tratamento sistêmico prévio, com duração mediana do benefício de 12,6 meses. Já naqueles com exposição prévia a ≤ 2 linhas de tratamento sistêmico (N = 69) a taxa de resposta foi de 41%, com duração mediana de 9,7 meses. Destaca-se que a taxa de controle de doença nas metástases no sistema nervoso central foi de 92,3%, com taxa de resposta objetiva de 54% e 31% de repostas completas.
A análise de segurança foi realizada com dados de todos os pacientes incluídos nas múltiplas coortes do estudo (N = 334), demonstrando que 34,6% dos pacientes tratados com capmatinibe apresentaram eventos adversos de graus ≥ 3 relacionados ao tratamento. As toxicidades mais frequentes em qualquer grau foram edema periférico (41,6%), náuseas (33,2%), elevação na creatinina sérica (19,5%) e vômitos (18,9%). A dose recomendada para o tratamento é 400 mg, por via oral, administrados duas vezes ao dia.
Associada a aprovação da droga, o FDA também aprovou o uso do FoundationOne® como teste complementar para a detecção das alterações de MET e indicação do tratamento. Como trata-se de uma aprovação acelerada, a aprovação definitiva de capmatinibe é dependente da confirmação dos resultados em estudos adicionais.
“Essa aprovação consagra o papel da mutação de MET tipo éxon 14 skipping como um evento promotor de carcinogênese e alvo terapêutico. O capmatinibe preenche uma lacuna importante em opções de tratamento para esses pacientes e representa mais um avanço importante na oncologia torácica de precisão”, destaca o Dr. William William, oncologista e diretor médico da Oncologia Clínica e Hematologia do Centro Oncológico da BP – A Beneficência Portuguesa de São Paulo.
Por Dr. Daniel Vargas P. de Almeida
