Continue sua leitura
Pembrolizumabe recebe aprovação para nova indicação de tratamento tumor-agnóstico nos EUA
O FDA (Food and Drug Administration) aprovou em 16 de junho de 2020 o uso do anticorpo anti-PD-1 pembrolizumabe no tratamento de pacientes adultos e pediátricos portadores de tumores com alta carga de mutação tumoral (TMB ≥ 10 mutações/megabyte), após progressão a terapia padrão. Em conjunto à aprovação do tratamento, o ensaio FoundationOneCDx também foi aprovado como teste diagnóstico para essa indicação de tratamento.
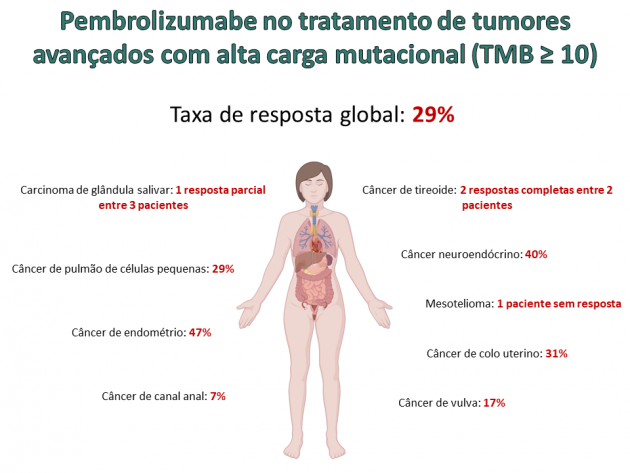
A eficácia de pembrolizumabe nesse cenário foi avaliada em uma análise retrospectiva de 10 coortes de pacientes incluídos no estudo KEYNOTE-158. No total, 102 pacientes apresentaram alta carga de mutação tumoral (13% da população) e o tratamento com pembrolizumabe foi associado a uma taxa de resposta de 29%, com 4% dos pacientes apresentando respostas completas. Destaca-se que dentro os sítios primários incluídos nessa análise, o câncer de pulmão de células pequenas correspondeu a maior parte dos casos (n = 34), sendo também incluídos o câncer de colo uterino (n = 16), câncer de endométrio (n = 15), câncer de canal anal (n = 14), câncer de vulva (n = 12), carcinoma neuroendócrinos (n = 5), carcinoma de glândulas salivares (n = 3), câncer de tireoide (n = 2) e mesotelioma (n = 1). A duração mediana de resposta não foi atingida, porém 57% dos pacientes que obtiveram resposta ao tratamento mantiveram o benefício por ≥ 12 meses, e 50% por ≥ 24 meses. Os resultados de segurança demonstram um perfil de toxicidade semelhante ao uso de pembrolizumabe em outras indicações.
Por Dr. Daniel Vargas P. de Almeida
