Continue sua leitura
Pembrolizumabe é aprovado pelo FDA para o tratamento do câncer gástrico ou da junção gastroesofágica HER-2 negativo
O FDA (Food and Drug Administration) aprovou, em 16 de novembro de 2023, o uso de pembrolizumabe associado a quimioterapia com fluoropirimidina e platina para o tratamento de primeira linha do adenocarcinoma gástrico ou da junção gastroesofágica (JGE) localmente avançado irresectável ou metastático HER-2 negativo.
Pembrolizumabe foi avaliado neste cenário no estudo KEYNOTE-859, que randomizou 1.579 pacientes com adenocarcinoma gástrico ou da JGE HER-2 negativo avançado entre pembrolizumabe ou placebo, combinados a quimioterapia à escolha do investigador (cisplatina e 5-FU ou oxaliplatina e capecitabina).
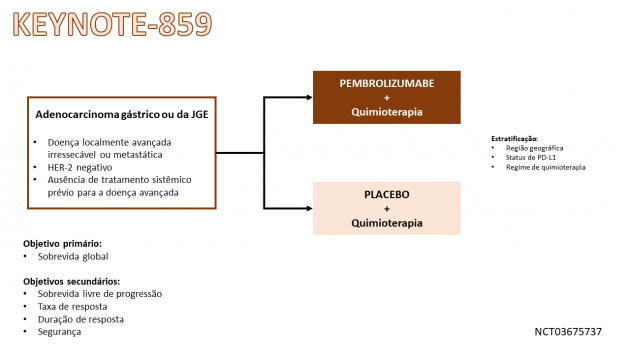
A combinação de pembrolizumabe e quimioterapia foi associada a benefícios em sobrevida global (SG), sobrevida livre de progressão (SLP) e taxa de resposta. A SG mediana foi 12,9 meses no braço pembrolizumabe e 11,5 meses no braço placebo (HR= 0,78; IC de 95%: 0,70-0,87; p < 0,0001). A SLP mediana foi 6,9 e 5,6 meses, respectivamente (HR=0,76; IC de 95%: 0,67-0,85; p < 0,0001). A taxa de resposta foi 51% e 42% (p < 0,0001) nos mesmos braços. Uma análise pré-especificada adicional mostrou benefício estatisticamente significativo em SG, SLP e taxa de resposta no pacientes tratados com pembrolizumabe também no tumores que expressam PD-L1 ≥ 1 e ≥ 10. Em análise exploratória nos pacientes com PD-L1 < 1, a SG mediana foi 12,7 e 12,2 meses nos braços pembrolizumabe e placebo (HR=0,92; IC de 95%: 0,73-1,17), respectivamente. No braço tratado com pembrolizumabe, a taxa de eventos adversos graves foi 45% e a taxa de descontinuação permanente em decorrência a eventos adversos foi 15%.
Ainda no mesmo mês, o FDA anunciou em 07 de novembro a revisão da aprovação de pembrolizumabe em combinação a trastuzumabe e quimioterapia para pacientes com adenocarcinoma gástrico ou da JGE localmente avançado irresectável ou metastático HER-2 positivo. A indicação atualizada restringe esta combinação aos pacientes com tumores expressando PD-L1 ≥ 1. Esta atualização deriva da análise de subgrupos conduzida nos pacientes com PD-L1 < 1 incluídos no estudo KEYNOTE-811 que sugere ausência de benefício do imunoterápico, tanto em relação a SG (HR=1,41; IC de 95%: 0,9-2,20) quanto a SLP (HR=1,03; IC de 95%: 0,65-1,64).
Por Dr. Daniel Vargas P. de Almeida
