Continue sua leitura
Pembrolizumabe é aprovado para o tratamento do câncer de mama triplo-negativo avançado
O FDA (Food and Drug Administration) anunciou em 13 de novembro de 2020 a aprovação acelerada do anticorpo anti-PD-1 pembrolizumabe para o tratamento de pacientes portadoras de câncer de mama triplo-negativo (CMTN) com recidiva local irressecável ou metastático com expressão positiva de PDL-1 (Combined Positive Score [CPS] ≥ 10), utilizando o anticorpo da Dako 22C3. A aprovação é baseada nos dados do estudo de fase III KEYNOTE-355.
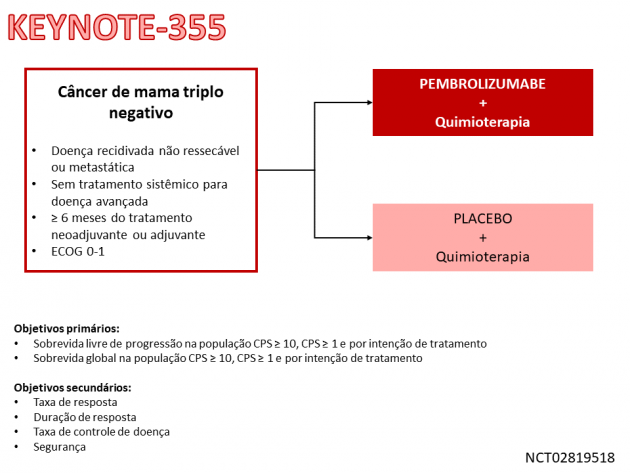
Nesse estudo, 847 pacientes com CMTN não candidatas a tratamento curativo foram randomizadas 2:1 entre terapia de primeira linha com pembrolizumabe ou placebo associados a quimioterapia à escolha do investigador (nab-paclitaxel, paclitaxel ou a combinação de gencitabina e carboplatina). Dentre os critérios de inclusão, as pacientes com doença recidivada deveriam ter finalizado o tratamento neoadjuvante ou adjuvante há pelo menos 6 meses. Os objetivos co-primários do estudo foram a sobrevida livre de progressão e a sobrevida global avaliadas de maneira hierárquica entre as pacientes com CPS ≥ 10, CPS ≥ 1 e na população por intenção de tratamento. Dentre a população incluída no estudo, 75% das pacientes em cada braço apresentava expressão de PDL-1 CPS ≥ 1 e 38% apresentava CPS ≥ 10.
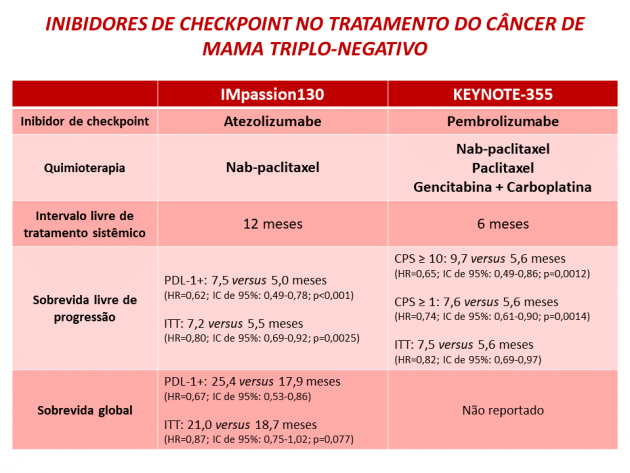
Os resultados finais da análise de sobrevida livre de progressão foram apresentados na ASCO Virtual Meeting 2020 com um seguimento mediano de 26 meses. Na avaliação das pacientes com CPS ≥ 10, a sobrevida livre de progressão mediana foi de 9,7 versus 5,6 meses para os braços pembrolizumabe e quimioterapia, respectivamente (HR=0,65; IC de 95%: 0,49-0,86; p=0,0012). A avaliação da sobrevida livre de progressão nos subgrupos de pacientes com CPS ≥ 1 e em toda a população não atingiram a significância estatística pré-determinada pelo estudo (HR=0,74; IC de 95%: 0,61-0,90; p=0,0014 e HR=0,82; IC de 95%: 0,69-0,97; respectivamente). A taxa de eventos adversos de graus ≥ 3 relacionados ao tratamento foi 68,1% versus 66,9% para os braços pembrolizumabe e quimioterapia, respectivamente, destacando-se anemia, neutropenia, náuseas, alopecia, fadiga e elevação de transaminases como os eventos adversos frequentes. A taxa de eventos adversos imuno-mediados foi 25,6% no braço pembrolizumabe, sendo 5,2% deles de graus ≥ 3.
A agência regulatória informou ainda que por tratar-se de aprovação acelerada, baseada no benefício demonstrado em sobrevida livre de progressão, a continuidade da aprovação definitiva é condicionada a confirmação do benefício em estudos clínicos e avaliações adicionais.
Dra. Debora Gagliato, oncologista da BP – A Beneficência Portuguesa de São Paulo, comenta a recente aprovação: “Há uma necessidade real de desenvolver novas opções de tratamento para pacientes com CMTN avançado, subtipo reconhecidamente agressivo, com desfechos de sobrevida muito aquém do desejado obtidos com quimioterapia citotóxica exclusiva. A aceitação pelo FDA da indicação de pembrolizumabe em primeira linha de CMTN avançado deve potencialmente aumentar o acesso das pacientes à imunoterapia, uma vez que o estudo admitiu a inclusão de pacientes com doença mais agressiva, com intervalo livre de recidiva de 6 meses ou superior, o que contrasta com o intervalo mínimo de 12 meses utilizado no estudo IMpassion130. Destaca-se a importância da publicação de dados confirmatórios em relação ao impacto da adição de pembrolizumabe à quimioterapia em sobrevida geral, evidência que ainda não foi compartilhada no estudo KEYNOTE 355”.
Por Dr. Daniel Vargas P. de Almeida
