Continue sua leitura
Pembrolizumabe aprovado nos EUA para o tratamento adjuvante do câncer de pulmão
O imunoterápico pembrolizumabe recebeu aprovação do FDA (Food and Drug Administration) em 26 de janeiro de 2023 para o tratamento adjuvante de pacientes com câncer de pulmão de células não pequenas (CPCNP) em estádios IB (T2a ≥ 4 cm), II ou IIIA submetidos a cirurgia e quimioterapia adjuvante baseada em platina.
O uso de pembrolizumabe neste cenário foi avaliado no estudo KEYNOTE-091 que randomizou 1.177 pacientes entre tratamento adjuvante com pembrolizumabe ou placebo por 1 ano após tratamento cirúrgico do CPCNP em estádios IB (≥ 4 cm), II ou IIIA. Não foi permitida a inclusão de pacientes tratados com quimioterapia ou radioterapia neoadjuvantes e 1.010 pacientes (86%) receberam quimioterapia adjuvante baseada em platina. Dentre os pacientes tratados com quimioterapia adjuvante, população de interesse na aprovação, a idade mediana foi 64 anos, 49% possuíam idade ≥ 65 anos, houve predominância de pacientes com doença estádio II (57%) frente aos estádios IB (11%) e IIIA (31%) e a distribuição dos pacientes de acordo com a expressão de PD-L1 foi semelhante (39% eram PD-L1 negativo, 33% com expressão entre 1 e 49% e 28% eram ≥ 50%).
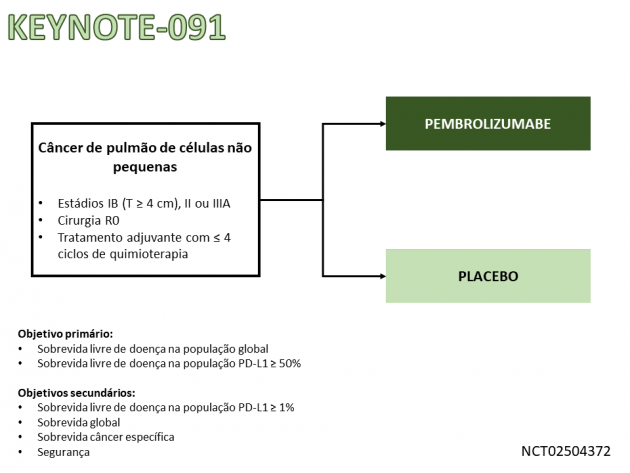
O estudo foi positivo para o seu desfecho primário, demonstrando benefício na sobrevida livre de doença com o uso de pembrolizumabe na população global (HR=0,76; IC de 95%: 0,63-0,91; p=0,0014). A avaliação nos pacientes com PD-L1 ≥ 50% ainda não demonstra benefício estatístico, ressaltando que a sobrevida livre de doença mediana não foi atingida em nenhum dos braços (HR=0,82; IC de 95%: 0,57-1,18; p=0,14). Na subpopulação selecionada pela exposição prévia a quimioterapia adjuvante, uma análise exploratória demonstrou que o uso de pembrolizumabe reduziu em 27% o risco de recidiva de doença ou morte comparado a placebo (HR=0,73; IC de 95%: 0,60-0,89). A avaliação de sobrevida global do estudo ainda possui dados imaturos, com apenas 42% dos eventos pré-especificados atingidos. Na avaliação de segurança, a incidência de eventos adversos foi semelhante àquela apresentada por pacientes recebendo pembrolizumabe em monoterapia para o tratamento do CPCNP em outros cenários, exceto pelas taxas de hipotireoidismo (22%), hipertireoidismo (11%) e pneumonite (7%). Ocorreram dois eventos adversos fatais no braço tratado com pembrolizumabe.
O Dr. William William, oncologista e diretor médico da Oncologia Clínica e Hematologia do Centro Oncológico da BP – A Beneficência Portuguesa de São Paulo, destaca que “esta aprovação ressalta os avanços que vêm sendo atingidos no contexto do câncer de pulmão não metastático, ampliando opções para os nossos pacientes. As recentes aprovações de neoadjuvância e adjuvância em populações definidas ou não por biomarcadores tornam imprescindível a discussão de casos de maneira multidisciplinar, para que a melhor estratégia seja aplicada individualmente para cada paciente”.
Por Dr. Daniel Vargas P. de Almeida
