Continue sua leitura
O avanço do DNA tumoral circulante nas decisões terapêuticas da oncologia
O DNA tumoral circulante (ctDNA) começou a ser explorado na oncologia como uma alternativa à biópsia tecidual para a identificação de alterações genéticas em tumores avançados, auxiliando na seleção de terapias-alvo e na identificação de resistência adquirida. Com os avanços tecnológicos e o aumento da sensibilidade dos testes, seu uso se expandiu para a estimativa de prognóstico, detecção de doença residual mínima e, mais recentemente, para a orientação de decisões terapêuticas, como na adjuvância, a exemplo do estudo DYNAMIC, no câncer de cólon ressecado, onde o uso do ctDNA orientou a indicação de quimioterapia.1
Atualmente, o ctDNA também vem sendo avaliado como ferramenta para monitoramento da resposta a tratamentos, complementando a avaliação clínica e radiológica. Essa abordagem tem demonstrado potencial para detectar resposta precoce ou falha terapêutica com maior sensibilidade do que os métodos convencionais de imagem. Nesse cenário, já estão disponíveis testes, como o Signatera™ (Natera), Guardant Reveal™ (Guardant Health), Oncodetect™ (Exact Sciences) e FoundationOne® Tracker (Foundation Medicine/Roche), embora ainda sem indicação formal nas diretrizes clínicas internacionais.
Nesse contexto, estudos recentes, incluindo alguns apresentados na ASCO 2025, consolidam o papel do ctDNA como marcador em diferentes fases da jornada oncológica, desde o seguimento após tratamento curativo, até a avaliação de resposta no tratamento neoadjuvante e no cenário metastático.
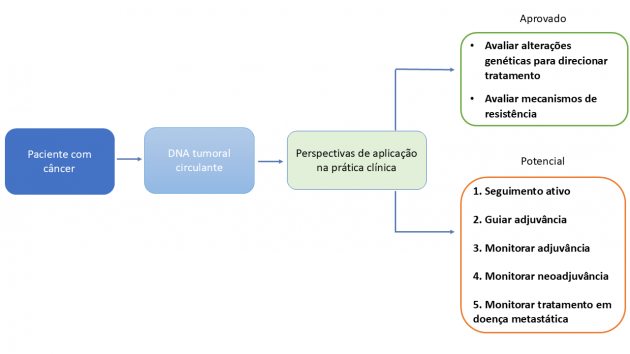
Seguimento ativo com ctDNA
Reforçando o potencial do ctDNA como ferramenta de vigilância em pacientes assintomáticos após tratamento curativo, uma análise retrospectiva recente com seguimento de 263 pacientes com diversos tumores e acompanhamento mínimo de seis meses mostrou que o ctDNA pós-operatório positivo esteve associado a um risco significativamente maior de recorrência: 71,3 no câncer de pulmão, 44,3 no colorretal, 37,6 no de mama e acima de 100 no gástrico. Além disso, a detecção do ctDNA antecipou a recidiva clínica em até 19,5 meses no colorretal, 14,4 no pulmonar, 11,0 no de mama, e entre 5 e 9 meses nos tumores gástrico, hepático e ovariano2.
Uso do ctDNA na decisão e monitoramento da adjuvância
No câncer de cólon estádio II, a atualização do estudo DYNAMIC confirmou que a estratégia guiada por ctDNA reduziu o uso de quimioterapia adjuvante (15%versus 28%) sem comprometer a sobrevida livre de recorrência em 5 anos (88% versus 87%) ou a sobrevida global (93,8% versus 93,3%).
Na adjuvância do câncer de mama RH positivo/HER-2 negativo, o estudo DARE, prospectivo e randomizado, apresentado na ASCO 2025, avaliou o monitoramento com ctDNA a cada seis meses durante a terapia endócrina adjuvante. Entre as 432 pacientes com resultados persistentemente negativos, a taxa de sobrevida livre de recidiva foi de 99% após mediana de 27,4 meses de seguimento, reforçando o alto valor preditivo negativo da estratégia. As pacientes ctDNA‑positivas foram randomizadas para mudança de tratamento com fulvestranto mais palbociclibe (braço A) ou manutenção da terapia endócrina em curso (braço B). A taxa de depuração do ctDNA foi superior no braço A (63% versus 22%), e a ausência de queda nos níveis do biomarcador esteve associada a maior risco de recidiva (HR=5,3; IC de 95%: 1,1-53; p=0,04)3.
Avaliação durante a neoadjuvância/tratamento perioperatório com ctDNA
Na ASCO 2025, os dados atualizados do estudo CheckMate 816 reforçaram o papel do ctDNA como marcador prognóstico em câncer de pulmão de células não pequenas (CPCNP) ressecável. Em análise exploratória de pacientes com ctDNA positivo no baseline, a taxa de depuração pré-operatório foi superior no grupo tratado com nivolumabe e quimioterapia (56%) em comparação à quimioterapia isolada (35%). A queda do ctDNA associou-se a melhora da sobrevida global (SG), com HR=0,38; (IC de 95%: 0,15-1,00) no braço com imunoterapia e HR=0,39 (IC de95%: 0,14-1,11) no braço controle4. No cenário do câncer urotelial, o estudo de fase III NIAGARA avaliou pacientes com câncer de bexiga músculo-invasivo tratados com durvalumabe associado à quimioterapia neoadjuvante em comparação à quimioterapia isolada, seguidos de cistectomia radical. A taxa de queda de ctDNA entre o início do tratamento e o período pré-operatório foi maior no braço com durvalumabe (41% versus 31%). Além disso, a sobrevida livre de doença em 12 meses foi significativamente superior no braço experimental (82,3%) em comparação ao controle (33,2%), reforçando o valor prognóstico da persistência de doença residual5.
Monitoramento de ctDNA no cenário metastático
No estudo de fase III SERENA-6, apresentado na ASCO 2025, foi avaliada uma estratégia de troca precoce de tratamento guiada por ctDNA em pacientes com câncer de mama RH positivo/HER-2 negativo avançado em uso de inibidor de aromatase (IA) associado a inibidor de CDK4/6. A detecção de mutações no gene ESR1 pelo ctDNA, antes da progressão clínica, foi utilizada como critério para randomização de 315 pacientes assintomáticas para troca do IA por camizestranto, mantendo o CDK4/6i. Essa intervenção precoce resultou em melhora significativa na sobrevida livre de progressão (SLP): 16,0 meses versus 9,2 meses, com HR de 0,44 (IC de 95%: 0,31-0,60; p<0,00001). Trata-se da primeira evidência de que o uso seriado de ctDNA pode identificar resistência emergente e permitir uma intervenção terapêutica antes da progressão radiológica6.
Esses estudos reforçam o papel do ctDNA como biomarcador, com aplicações em diferentes fases da jornada oncológica. Embora ainda não incorporado formalmente às diretrizes, o ctDNA surge como ferramenta importante da oncologia de precisão, com potencial para antecipar decisões clínicas, evitar tratamentos ineficazes e guiar condutas.
Por Dr. Caio Leite
Referências
- Tie J, et al. Circulating tumor DNA analysis guiding adjuvant therapy in stage II colon cancer: 5-year outcomes of the randomized DYNAMIC trial. Nat Med. 2025; 31(5):1509-1518.
- Hoang V, et al. Real-world utilization and performance of circulating tumor DNA monitoring to predict recurrence in solid tumors. JCO Oncol Adv. 2025; 2(4).
- Pusztai L, et al. Circulating tumor (ct)DNA monitoring of ER+/HER2– high-risk breast cancer during adjuvant endocrine therapy. J Clin Oncol. 2025; 43(16_suppl):1010.
- Forde PM, et al. Overall survival with neoadjuvant nivolumab (NIVO) + chemotherapy in patients with resectable NSCLC in CheckMate 816. J Clin Oncol. 2025;43(17_suppl):LBA8000.
- Powles T, et al. Circulating tumor DNA (ctDNA) in patients with muscle-invasive bladder cancer (MIBC) who received perioperative durvalumab (D) in NIAGARA. J Clin Oncol. 2025;43(16_suppl):4503.
- Turner NC, et al. Camizestrant + CDK4/6 inhibitor (CDK4/6i) for the treatment of emergent ESR1 mutations during first-line (1L) endocrine-based therapy (ET) and ahead of disease progression in patients (pts) with HR+/HER2– advanced breast cancer (ABC): Phase 3, double-blind ctDNA-guided SERENA-6 trial. J Clin Oncol. 2025;43(17_suppl): LBA4.
