Continue sua leitura
Novo tratamento alvo-direcionado para o câncer de mama avançado é aprovado nos EUA
Uma nova terapia-alvo foi aprovado pelo FDA em 16 de novembro de 2023 para o tratamento de pacientes com câncer de mama. Trata-se do capivasertibe, que recebeu aprovação regulatória para, em combinação com fulvestranto, ser utilizado no tratamento de pacientes adultos com câncer de mama com receptor hormonal positivo (RH positivo) HER-2 negativo, localmente avançado ou metastático, com uma ou mais alterações em PIK3CA/AKT1/PTEN, após progressão a ≥ 1 regime à base de hormonioterapia no contexto metastático ou recidivado ou dentro de 12 meses após término da hormonioterapia adjuvante.
A combinação foi avaliada no estudo CAPItello-291, que incluiu 708 pacientes com câncer de mama RH positivo HER-2 negativo, localmente avançado ou metastático, dentre os quais 289 pacientes apresentavam tumores com alterações em PIK3CA/AKT1/PTEN. Todos os pacientes deveriam ter progredido a tratamento com inibidor da aromatase. Os pacientes podiam ter recebido até duas linhas prévias de hormonioterapia e até uma linha de quimioterapia para doença localmente avançada ou metastática. A randomização aconteceu a uma razão 1:1 entre capivasertibe ou placebo em associação a fulvestranto. Merece destaque que foram excluídos pacientes com alterações importantes de glicemia (definidos como pacientes com diabetes mellitus tipo 1 e diabetes mellitus tipo 2 necessitando de insulina ou com hemoglobina glicada ≥ 8%). Dentre a população avaliada que apresentava alteração do biomarcador, 66% apresentavam alteração de PIK3CA, 13% alterações de AKT1 e 17% alterações de PTEN. Sobre os tratamentos prévios, 71% já haviam recebido um inibidor de ciclinas e 18% já haviam recebido quimioterapia para a doença avançada.
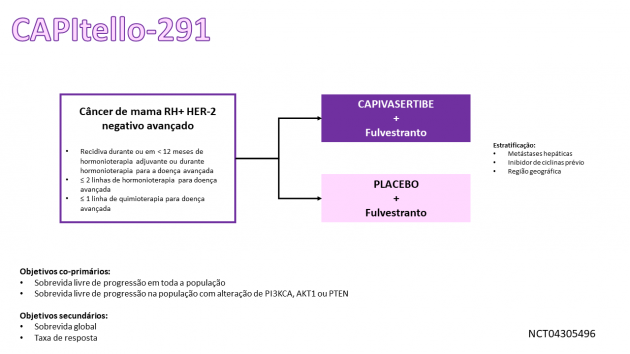
Na população por intenção de tratamento, foi demonstrado benefício do uso de capvasertibe na sobrevida livre de progressão (SLP). Uma análise exploratória de SLP nos 313 (44%) pacientes cujos tumores não apresentavam alteração em PIK3CA/AKT1/PTEN mostrou HR=0,79 (IC de 95%: 0,61-1,02), indicando que a diferença na população geral foi atribuída principalmente aos resultados vistos na população com a presença do biomarcador. Nos 289 pacientes com tumores apresentando alterações em PIK3CA/AKT1/PTEN, a SLP mediana foi 7,3 meses no braço capivasertibe e 3,1 meses no braço placebo (HR=0,50; IC de 95%: 0,38-0,65; p < 0,0001). Os eventos adversos mais frequentes nos pacientes que receberam capvasertibe (reportados em ≥ 20% dos pacientes), incluindo anormalidades laboratorais, foram: diarreia, eventos adversos cutâneos, hiperglicemia, linfopenia, anemia, náuseas, fadiga, leucopenia, hipertrigliceridemia, neutropenia, elevação de creatinina, vômitos e estomatite.
A dose de tratamento recomendada é capivasertive 400 mg, via oral, duas vezes ao dia, com ou sem alimentos, por 4 dias seguidos de 3 dias de pausa, até progressão de doença ou toxicidade limitante. A dose de fulvestranto usando em associação é de 500 mg, via intramuscular, nos D1 e D15 do ciclo 1 e depois a cada 28 dias.
O FDA também aprovou o teste FoundationOne® como teste diagnóstico para elegibilidade ao tratamento.
Por Dr. Daniel Vargas P. de Almeida
