Continue sua leitura
Novo radiofármaco recebe aprovação para o tratamento do câncer de próstata nos Estados Unidos
O FDA (Food and Drug Administration) aprovou em 26 de março de 2022 o uso do rádiofármaco lutécio-177 vipivotida tetraxetan (Lu177) para o tratamento de pacientes com câncer de próstata metastático resistente a castração com expressão positiva de PSMA após exposição a um novo agente anti-androgênico e quimioterapia baseada em taxano. No mesmo dia foi também aprovado pela agência o uso de gálio-68 gozetotida, um agente radioativo utilizado para a realização de PET-CT PSMA, que se torna o primeiro agente desta classe aprovado para a seleção de pacientes candidatos a tratamento com Lu177-PSMA. Para cumprir a elegibilidade ao tratamento, os pacientes necessitam apresentar captação de gálio-68 em nível superior ao hepático em ao menos uma lesão neoplásica. Serão excluídos do tratamento pacientes com lesões caracterizadas como neoplásicas pelas suas dimensões e que não apresentem captação ao gálio-68 em valor superior ao hepático.
O tratamento com Lu177-PSMA foi avaliado no estudo de fase III VISION, que randomizou 831 pacientes com câncer de próstata metastático resistente a castração com expressão de PSMA a uma razão 2:1 entre Lu-177 PSMA associado a melhor cuidado clínico ou melhor cuidado clínico isolado. Para a inclusão no estudo era necessária a exposição a pelo menos um novo agente anti-androgênico e 1-2 linhas de quimioterapia com taxanos. Dentre a população incluída, 12,2% dos pacientes possuíam metástases hepáticas, 41% haviam recebido 2 novos agentes anti-androgênicos e 41,2% haviam recebido 2 esquemas quimioterápicos baseados em taxanos.
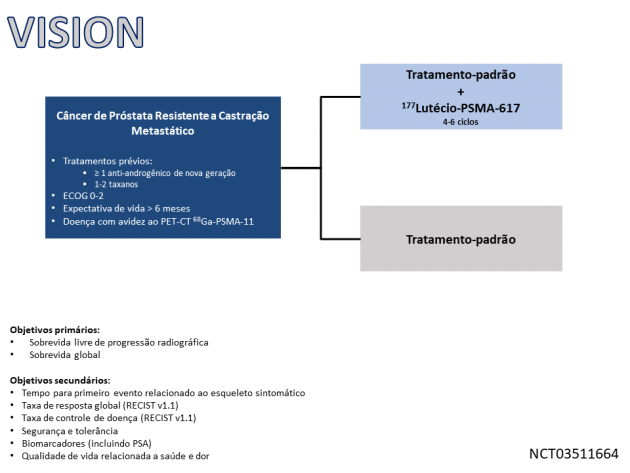
O estudo atingiu seus objetivos primários, demonstrando que o tratamento com Lu177-PSMA foi associado a benefício em sobrevida livre de progressão radiográfica (HR=0,40; IC de 99,2%: 0,29-0,57) além de reduzir em 38% o risco de morte (HR=0,62; IC de 95%: 0,52-0,74), com sobrevida global mediana de 15,3 versus 11,3 meses. A taxa de resposta objetiva também foi superior no braço de Lu177-PSMA (41,8% versus 3%). Na avaliação de segurança, o tratamento com Lu177-PSMA foi associado a uma taxa de eventos adversos de graus ≥ 3 de 52,7%, sendo as principais toxicidades apresentadas fadiga, xerostomia, náuseas, anemia, redução do apetite e constipação.
A dose de tratamento recomendada de Lu177-PSMA é 7,4 GBq (200 mci), via intravenosa, a cada 6 semanas até a conclusão de 6 doses, toxicidade limitante ou progressão de doença.
Por Dr. Daniel Vargas P. de Almeida
