Continue sua leitura
Novas opções de tratamento para o câncer de rim metastático no Brasil
A Agência Nacional de Vigilância Sanitária (ANVISA) aprovou três novas terapias para o tratamento do câncer de rim metastático no Brasil: uma combinação de imunoterápicos e duas novas opções de tratamento oral.
A primeira delas, representada pela combinação dos agentes imunoterápicos ipilimumabe e nivolumabe, recebeu aprovação para tratamento do câncer de rim avançado de risco alto ou intermediário (critérios IMDC) sem tratamento prévio. A combinação das drogas orais lenvatinibe e everolimo foi aprovada para os pacientes com progressão a terapia prévia a inibidor de VEGFR. Já o inibidor multiquinase (MET, VEGFR, AXL) cabozantinibe foi aprovado para o tratamento da doença avançada em dois diferentes cenários: em pacientes sem tratamento prévio para a doença avançada, bem como naqueles que apresentaram progressão de doença após tratamento com um inibidor de tirosina quinase do VEGFR.
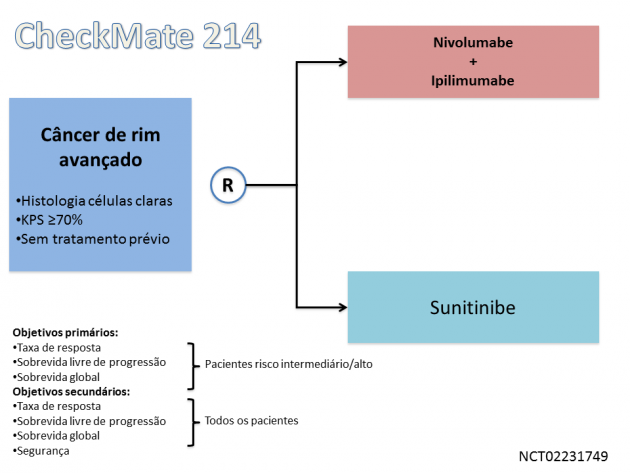
A indicação de tratamento com os imunoterápicos baseia-se no estudo fase III CheckMate 214, que randomizou 1096 pacientes com câncer de rim avançado para receberem tratamento de primeira linha com a combinação dos anticorpos monoclonais ipilimumabe (anti-CTLA-4) + nivolumabe (anti-PD-1) ou o inibidor de tirosina quinase sunitinibe.
Após um seguimento mediano de 25,2 meses, os pacientes de risco alto e intermediário tratados com a combinação de imunoterapia apresentaram redução de 47% no risco de morte, em comparação àqueles que receberam sunitinibe (HR=0,63; p<0,001), bem como benefício em taxa de resposta (42% versus 27%; p<0,001), atingindo uma taxa de resposta completa com o tratamento da ordem de 9%. A sobrevida livre de progressão foi numericamente superior (mediana de 11,6 versus 8,4 meses), porém sem atingir significância estatística (HR=0,82; p=0,03).
A taxa de eventos adversos foi semelhante entre os braços de tratamento (93% versus 97%), com perfis diferentes de toxicidades inerentes às classes de drogas. Porém, a taxa de descontinuação do tratamento por eventos adversos foi maior no braço de ipilimumabe + nivolumabe (22% versus 12%).
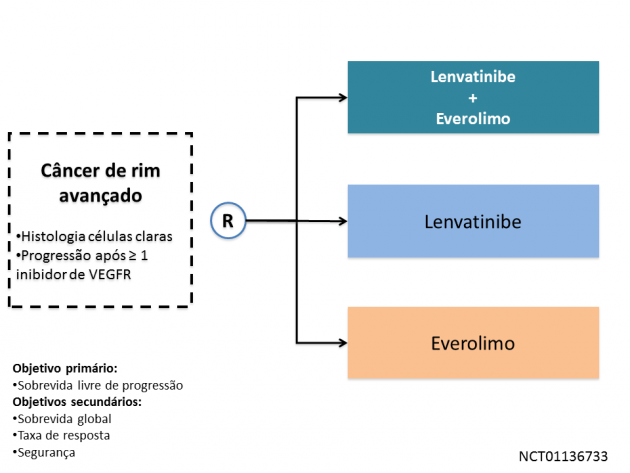
A segunda aprovação anunciada, o tratamento com lenvatinibe e everolimo, teve como base um estudo de fase II com 153 pacientes com câncer de rim avançado que haviam apresentado progressão de doença após terapia com inibidor de VEGFR. Os pacientes foram randomizados para receberem lenvatinibe, everolimo, ou a combinação das drogas. O uso da terapia combinada promoveu benefício estatisticamente significativo em sobrevida livre de progressão em comparação a everolimo (HR=0,40; IC de 95%: 0,24-0,68; p=0,0005), bem como o uso exclusivo de lenvatinibe, que também foi superior a everolimo neste desfecho (HR=0,61; IC de 95%: 0,38-0,98; p=0,048). A taxa de eventos adversos de graus ≥3 foi superior com o uso de lenvatinibe + everolimo (71%) em comparação a everolimo isolado (50%), entretanto foi inferior à monoterapia com lenvatinibe (79%), destacando como principais eventos adversos diarreia (20%) e proteinúria (19%).
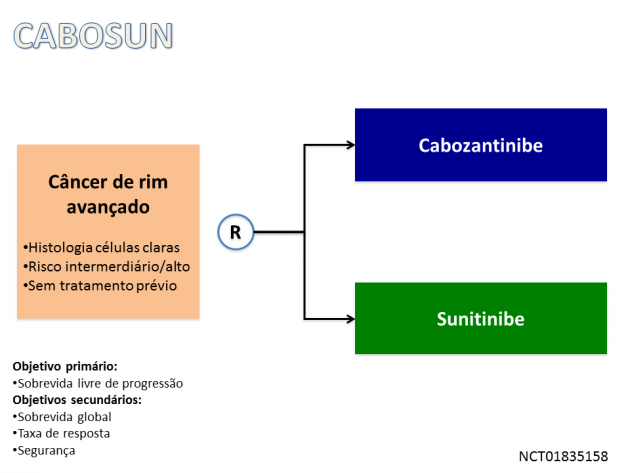
Em relação ao uso de cabozantinibe, o primeiro cenário de tratamento aprovado é baseado no estudo de fase II CABOSUN, que randomizou 157 pacientes com carcinoma de células renais avançado de risco intermediário e alto (critérios IMDC) para receberem como primeiro regime de tratamento sistêmico cabozantinibe ou sunitinibe. Em análise atualizada dos dados, com seguimento mediano de 25 meses, o uso de cabozantinibe promoveu redução de 52% no risco de progressão de doença ou morte em relação ao uso de sunitinibe (SLP medianas 8,6 versus 5,3 meses, HR=0,48; IC de 95%: 0,31-0,74; p=0,0008). Houve ganho também em taxa de resposta (20% versus 9%). Em relação à sobrevida global, o estudo sugere benefício com o uso de cabozantinibe (SG medianas 26,6 versus 21,2; HR=0,8; IC de 95%: 0,53-1,21), entretanto os dados não atingiram significância estatística, fato que os autores justificam pelo número restrito de pacientes incluídos no estudo.
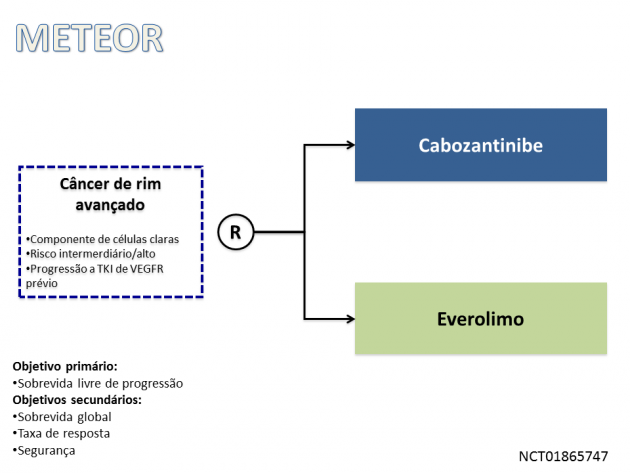
Já no cenário de pacientes que apresentaram progressão de doença após tratamento com um inibidor de tirosina quinase do VEGFR previamente, a indicação de uso é baseada no estudo de fase III METEOR. Nesse estudo, foram randomizados 658 pacientes para receberem tratamento com cabozantinibe ou everolimo até progressão de doença ou toxicidade limitante. Como resultados, o uso de cabozantinibe foi associado à redução de 44% no risco de morte quando comparado ao tratamento com everolimo (SG medianas 21,4 versus 16,5 meses; HR=0,66; IC de 95%: 0,53-0,83; p=0,00026), bem como promoveu benefício em sobrevida livre de progressão (HR=0,51; p<0,0001) e taxa de resposta (17% versus 3%, p<0,0001).
Nas avaliações de segurança, o uso de cabozantinibe apresenta taxa de eventos adversos de graus ≥3 entre 39-68%, destacando-se como os mais prevalentes hipertensão, diarreia e fadiga, toxicidades característica dessa classe de medicamentos.
De acordo com o Dr. Fabio Schutz, oncologista da BP – A Beneficência Portuguesa de São Paulo, “esta é uma ótima notícia para pacientes com câncer de rim avançado. A ANVISA, em duas semanas, aprovou três novos tratamentos para pacientes com câncer de rim avançado: lenvatinibe + everolimo, cabozantinibe e ipilimumabe + nivolumabe. Pela primeira vez, a imunoterapia chega à primeira linha de tratamento no câncer de rim metastático. O estudo fase III CheckMate 214 mostrou aumento significativo de sobrevida global em pacientes com risco intermediário ou alto. A indicação deve ser incorporada rapidamente como primeira opção de tratamento para estes pacientes. Outras opções de tratamento com imunoterapia também estão sendo avaliadas, mas todas com combinação de inibidores de angiogênese, e inclusive com resultados preliminares na imprensa positivos (estudo JAVELIN Renal 101 e KEYNOTE-426). Cabozantinibe também recebeu aprovação pela ANVISA no mesmo dia para tratamento de pacientes tanto na primeira quanto na segunda linha de tratamento. O estudo fase II CABOSUN mostrou superioridade do cabozantinibe em relação ao sunitinibe na primeira linha de tratamento, com aumento da resposta objetiva e da SLP, mas sem poder estatístico para mostrar aumento de sobrevida global. No entanto, o estudo fase III METEOR avaliou apenas pacientes na segunda ou terceira linhas de tratamento, incluindo uma pequena proporção de pacientes previamente tratados com nivolumabe, comparando o cabozantinibe com a terapia-padrão à época (everolimo) e mostrou aumento de resposta objetiva, sobrevida livre de progressão e sobrevida global. O cabozantinibe é o primeiro inibidor multiquinase com capacidade de inibição do receptor MET a ser aprovado em câncer de rim. Importante lembrar que o MET é um dos mecanismos de escape e resistência aos inibidores de VEGFR. Quem ganha são os pacientes com câncer de rim, que agora podem contar com novas opções de tratamento no arsenal“.
Por Dr. Daniel Vargas P. de Almeida
