Continue sua leitura
Nova terapia-alvo aprovada no Brasil para diversos tipos de tumores
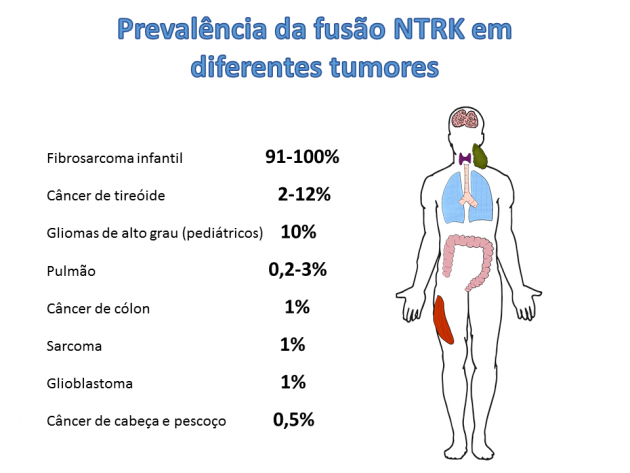
As fusões envolvendo os genes NTRK (neurotrophic receptor tyrosine kinase) estão sabidamente envolvidas no processo da oncogênese, e apesar de extremamente raras, as terapias dirigidas contra esse alvo têm demonstrado taxas de resposta bastante animadoras em estudos clínicos. A grande possibilidade aberta com a introdução dessas terapias reside na possibilidade de tratar de maneira mais eficaz tumores considerados mais raros, porém que possuem uma frequência maior de apresentação dessa mutação, como o carcinoma de glândula salivar análogo mamário, carcinoma de mama secretor e o fibrossarcoma congênito infantil, nos quais essa alteração pode estar presente em até 80% dos casos, bem como alguns tipos de tumores cerebrais pediátricos. Baseado nas altas taxas de respostas em doenças por vezes consideradas “órfãs” de tratamentos efetivos, a ANVISA (Agência Nacional de Vigilância Sanitária) aprovou em junho de 2019 a terapia-alvo larotrectinibe, um inibidor de TRK (tropomyosin receptor kinase), para o tratamento de pacientes adultos e pediátricos com tumores sólidos localmente avançados ou metastáticos que apresentam fusão do gene NTRK.
A avaliação do tratamento com larotrectinibe foi realizada através da combinação de 3 estudos clínicos que combinados incluíram 55 pacientes adultos e pediátricos portadores de diferentes tumores que apresentavam fusão do gene NTRK (e ausência de mecanismos de resistência conhecidos) para os quais a doença apresentava-se em estádio metastático, ou cuja ressecção poderia resultar em elevada morbidade. Dentre os 17 diferentes sítios primários incluídos no estudo (carcinoma de glândula salivar, fibrossarcoma infantil, câncer de tireoide, cólon, pulmão, melanoma, GIST, entre outros), a taxa de resposta objetiva obtida com o uso de larotrectinibe foi de 75% em análise do comitê de revisão independente, destacando-se 13% de pacientes com resposta completa. Com 1 ano de seguimento 71% dos respondedores ainda mantinham o benefício, e a duração de resposta mediana ainda não foi atingida.
Os principais efeitos adversos apresentados com o tratamento foram fadiga, náusea, tosse, alteração do hábito intestinal, tontura, vômitos e elevação de transaminases, ressaltando-se que 93% de todos os efeitos adversos foram de graus 1-2, e não houve eventos adversos sérios (graus igual ou maior a 3) relacionados ao tratamento.
A aprovação dessa droga nos EUA ocorreu em novembro de 2018, sendo bastante ressaltado o caráter inovador dessa aprovação baseada em um marcador, independente do sítio primário do tumor, caracterizando-a como uma “terapia agnóstica”. O Brasil é o segundo país do mundo a aprovar o uso de larotrectinibe, através do processo de aprovação de terapias para doenças raras, disponível pela ANVISA.
Conforme ressalta o Dr. Gustavo Schvartsman, oncologista do Hospital Israelita Albert Einstein, “o larotrectinibe é o primeiro medicamento no Brasil aprovado para uma alteração molecular, e não para um tumor específico. Destaca-se a profundidade de resposta, que ocorre na maior parte dos pacientes, e a durabilidade, cuja mediana ainda não foi atingida. Entramos em uma nova era de tratamentos, onde cada vez mais as alterações no DNA tumoral ganham papel mais relevante, podendo ser compartilhadas por inúmeros tipos histológicos de câncer. O desafio pela frente será o de ampliar o rastreio para encontrar a alteração nos tumores que foram estudados, através de imunohistoquímica e NGS (next generation sequencing), e o de facilitar o acesso ao medicamento, que será de custo elevado e não será contemplado pelo rol da ANS como procedimento obrigatório até pelo menos 2023, visto que não foi submetido para análise da próxima atualização em 2021”.
Por Dr. Daniel Vargas P. de Almeida
