Continue sua leitura
Nova opção de terapia alvo para tratamento do câncer de pulmão metastático
Foi publicado no Diário Oficial da União em 16 de abril de 2018 a inclusão pela Agência Nacional de Vigilância Sanitária (ANVISA) de uma nova indicação de tratamento com o inibidor de EGFR de terceira geração osimertinibe para o tratamento do câncer de pulmão de células não pequenas portador de mutação do gene EGFR sem tratamento prévio.
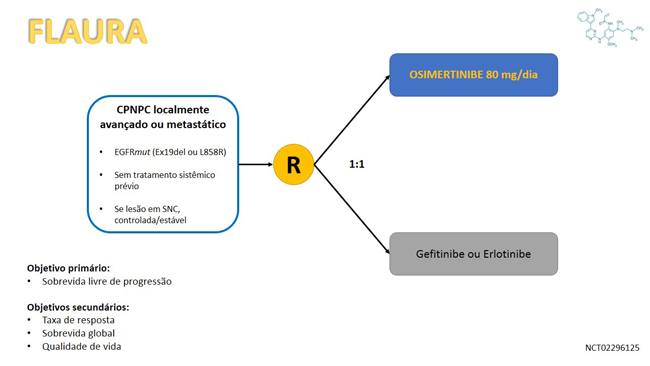
Esta aprovação baseia-se no estudo fase III FLAURA, que randomizou 556 pacientes com câncer de pulmão de células não pequenas avançado portadores de mutação de sensibilidade do EGFR (deleção do éxon 19 ou L858R) para receberem tratamento com o inibidor de tirosina quinase do EGFR de terceira geração osimertinibe ou algum dos outros inibidores de EGFR padrões (gefitinibe ou erlotinibe).
O estudo atingiu seu objetivo primário com ganho estatisticamente significativo de 8,7 meses em sobrevida livre de progressão a favor do grupo de pacientes que recebeu osimertinibe (18,9 versus 10,2 meses, HR 0,46; IC 95% 0,37-0,57, p<0,001). O uso do inibidor de terceira geração também foi associado a uma maior duração mediana de resposta (17,2 versus 8,5 meses), atingiu uma taxa de resposta de 80%. Ademais, foi numericamente superior em relação à sobrevida em 18 meses (83% versus 71%), com dados de sobrevida global ainda imaturos na análise interina. Em relação às toxicidades, o tratamento com osimertinibe demonstrou menor taxa de eventos adversos de grau ≥3 (34% versus 45%).
Esta aprovação chega como uma nova opção de tratamento para os pacientes com câncer de pulmão avançado portadores de uma mutação genética pontual diretamente ligada na etiopatogênese da doença. A frequência da mutação do EGFR é da ordem de 15% na população geral, porém chega até 43% em pacientes caucasianos nunca tabagistas.
Vale ressaltar que o Brasil foi o primeiro país do mundo a aprovar o uso da medicação em pacientes sem tratamento prévio, antes mesmo dos Estados Unidos, onde a aprovação foi divulgada pelo Food and Drug Administration ontem (19 de abril).
Por Dr. Daniel Vargas P. de Almeida.
Veja também:
