Continue sua leitura
Mirvetuximabe recebe aprovação regulatória definitiva nos EUA
No dia 22 de março de 2024, o FDA (Food and Drug Administration) concedeu aprovação a mirvetuximabe soravtansina para o tratamento de pacientes adultas com carcinoma epitelial de ovário, tuba uterina ou primário de peritônio positivo para a expressão de receptor de folato alfa (FRα) e resistente a platina, que já tenham sido submetidas a 1-3 regimes de tratamento sistêmico prévios. Anteriormente, a droga já havia recebido aprovação acelerada para esta indicação.
A eficácia do medicamento foi avaliada no estudo MIRASOL, que incluiu 453 pacientes com câncer epitelial de ovário, de tuba uterina ou primário de peritônio platino-resistente previamente tratadas com ≥ 3 três linhas de terapia sistêmica e positivos para a expressão de FRα. As participantes foram randomizadas (1:1) para receber mirvetuximabe soravtansina ou quimioterapia a escolha do investigador (paclitaxel, doxorrubicina lipossomal peguilada ou topotecano) até progressão da doença ou toxicidade limitante. Como características demográficas da população incluída, a idade mediana foi 63 anos, 47% haviam recebido 3 linhas terapêuticas prévias, 62% haviam recebido bevacizumabe previamente e 55% haviam recebido um inibidor da PARP.
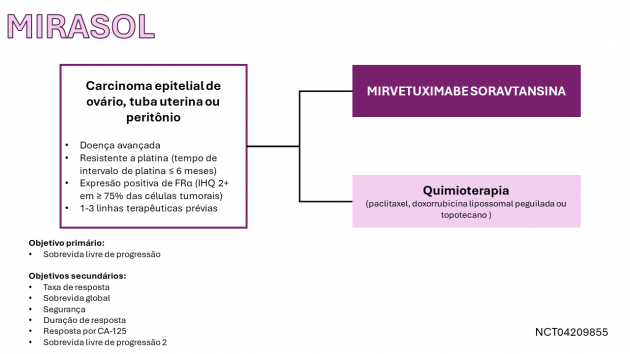
A sobrevida global mediana foi de 16,5 meses no braço mirvetuximabe soravtansina e de 12,7 meses no braço de quimioterapia (HR=0,67; IC de 95%: 0,50-0,88; p=0,0046). A sobrevida livre de progressão mediana foi de 5,6 e 4,0 meses (HR=0,65; IC de 95%: 0,52- 0,81; p<0,0001) para os mesmos braços, respectivamente. A taxa de resposta foi de 42% e 16% (p<0,0001), respectivamente. Os eventos adversos mais frequentes (≥ 20%), incluindo anormalidades laboratoriais, foram: aumento de transaminases, fadiga, borramento da visão, náuseas, elevação da fosfatase alcalina, diarreia, dor abdominal, ceratopatia, neuropatia periférica, dor musculoesquelética, linfopenia, plaquetopenia, hipomagnesemia, anemia, xeroftalmia, constipação, leucopenia, vômitos, hipoalbuminemia, hiporexia e neutropenia. Na bula, há um destaque especial para o risco de toxicidade ocular, pneumonite, neuropatia periférica e toxicidade em embriões e fetos.
Por Dr. Daniel Vargas P. de Almeida
