Continue sua leitura
Microbiota intratumoral e resistência à imunoterapia
Em texto anterior publicado pelo MOC sobre microbioma e câncer (1), foi discutido como o microbioma intestinal influencia a carcinogênese, a resposta à imunoterapia e a modulação dos eventos adversos associados aos tratamentos oncológicos. Nesse sentido, a microbiota intestinal atua predominantemente como um regulador sistêmico da imunidade antitumoral, interferindo na ativação e na eficácia das respostas imunes.
Evidências mais recentes indicam que essa influência pode ocorrer também de forma local, diretamente no interior do tumor (2). Em uma coorte de 28 pacientes com carcinoma espinocelular de orofaringe tratados com durvalumabe e quimioterapia no cenário neoadjuvante, observou-se que a eficácia da imunoterapia não foi determinada por fatores habitualmente utilizados na prática oncológica, como estágio da doença, status de HPV, tabagismo, expressão de PD-L1 ou carga mutacional tumoral. Em contraste, o parâmetro que melhor distinguiu respondedores de não respondedores foi a quantidade total de bactérias presente no tecido tumoral.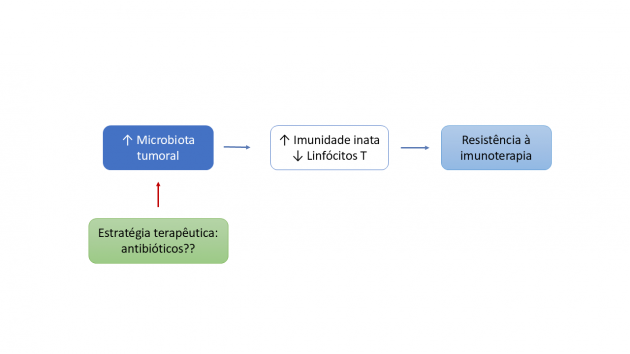
Importante destacar que nenhuma espécie bacteriana isoladamente foi capaz de predizer resposta terapêutica, incluindo gêneros como Fusobacterium, apesar de sua correlação com maior carga bacteriana total. O determinante clínico central identificado foi a carga bacteriana intratumoral, avaliada de forma quantitativa. Pacientes com tumores classificados como de baixa carga bacteriana concentraram as respostas clínicas e patológicas à imunoterapia, enquanto aqueles com alta carga bacteriana intratumoral apresentaram predominância de resistência primária ao tratamento. Essa associação refletiu-se também em desfechos exploratórios de sobrevida livre de progressão significativamente inferior nos pacientes com alta carga bacteriana intratumoral.
Do ponto de vista do microambiente tumoral, tumores com alta carga bacteriana apresentaram um perfil imunológico distintivo, caracterizado por expansão de neutrófilos intratumorais, redução significativa de células T CD8⁺ e de células B, e aumento da razão neutrófilo/linfócito no próprio tumor. Adicionalmente, análises transcriptômicas revelaram aumento da expressão de quimiocinas e citocinas associadas ao recrutamento e à ativação de neutrófilos, como CXCL1, CXCL2, CXCL8, CSF2 e CSF3, configurando um ambiente inflamatório inato crônico e desfavorável à imunidade adaptativa antitumoral.
Essas associações foram sustentadas por modelos experimentais pré-clínicos cuidadosamente delineados. Em modelos murinos ortotópicos, a redução da carga bacteriana intratumoral resultou em diminuição do infiltrado neutrofílico, aumento da infiltração de linfócitos T CD8⁺ e recuperação da sensibilidade ao bloqueio de PD-L1. Em sentido oposto, o aumento deliberado da carga bacteriana intratumoral, inclusive por meio da introdução de bactérias comensais, foi suficiente para induzir resistência à imunoterapia, demonstrando que o efeito observado está diretamente relacionado à quantidade bacteriana e ocorre de forma independente da espécie bacteriana.
O estudo aborda de forma crítica o papel dos antibióticos no contexto da imunoterapia, tema marcado por evidências conflitantes. Em tumores sólidos com baixa carga bacteriana intratumoral, estudos prévios sugerem associação entre antibióticos e pior resposta ao bloqueio de checkpoint, possivelmente pelo impacto negativo sobre a microbiota intestinal. Em contraste, no carcinoma espinocelular de cabeça e pescoço, observou-se maior benefício clínico da imunoterapia em pacientes que receberam antibióticos. Diante das limitações metodológicas dos estudos anteriores, os autores propõem que a quantificação da carga bacteriana intratumoral possa orientar o uso racional de antibióticos em associação à imunoterapia, estratégia atualmente avaliada em ensaios clínicos em andamento (NCT06627270).
Em conjunto, esses achados ampliam de forma substancial o conceito previamente discutido pelo MOC de que o microbioma influencia a oncologia exclusivamente por meio do eixo intestinal. A identificação da carga bacteriana intratumoral como um biomarcador quantitativo de resposta à imunoterapia abre caminho para estratégias mais refinadas na oncologia de precisão, incluindo a seleção de pacientes para tratamento e o uso mais racional de antibióticos, ao mesmo tempo em que levanta novas questões sobre como modular terapeuticamente o microambiente tumoral.
Por Dr. Caio Leite
Referências:
- O papel do microbioma intestinal no câncer: implicações na etiologia e no manejo clínico. MOC Brasil – Manual de Oncologia Clínica do Brasil. Publicação científica, 27 maio 2025. Disponível em: https://mocbrasil.com/blog/noticias/o-papel-do-microbioma-intestinal-no-cancer-implicacoes-na-etiologia-e-no-manejo-clinico/
- Silver NL, et al. Intratumoral bacteria are immunosuppressive and promote immunotherapy resistance in head and neck squamous cell carcinoma. Nat Cancer. 2026. Epub ahead of print.
