Continue sua leitura
Lurbinectedina aprovado para o tratamento de segunda linha do câncer de pulmão de células pequenas nos EUA
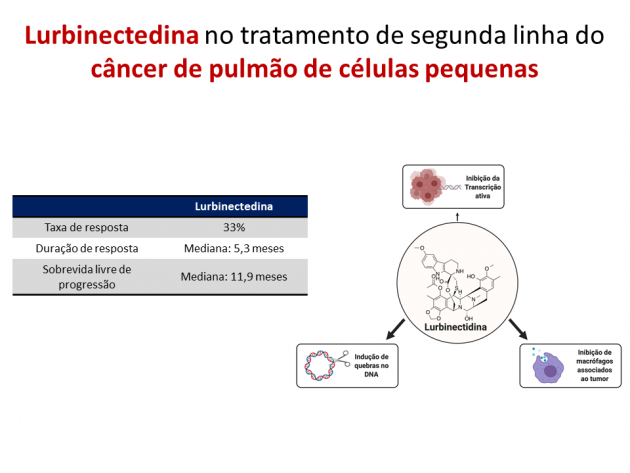
Em 15 de junho de 2020, o FDA (Food and Drug Administration) concedeu aprovação acelerada a lurbinectedina para o tratamento de pacientes com câncer de pulmão de células pequenas previamente tratados com quimioterapia baseada em platina conforme os resultados do estudo de fase II PM1183-B-005-14. Trata-se de um inibidor seletivo da transcrição oncogênica que promove a apoptose celular, além de afetar o microambiente tumoral através da atuação na transcrição de macrófagos associados ao tumor.

No estudo PM1183-B-005-14, o tratamento com lurbinectedina 3,2 mg/m2 a cada 21 dias foi avaliado em 105 pacientes com câncer de pulmão de células pequenas metastático previamente tratados. O objetivo primário do estudo foi a taxa de resposta avaliada pelos investigadores. Com um seguimento mediano de 17,1 meses, o tratamento com lurbinectedina foi associado a taxa de resposta de 35%, com uma duração mediana do benefício de 5,3 meses. Destaca-se que a taxa de resposta foi superior nos pacientes com intervalo livre de quimioterapia ≥ 90 dias em relação àqueles com intervalo < 90 dias (45% versus 22,2%, respectivamente). A sobrevida livre de progressão mediana foi 3,5 meses e a sobrevida global mediana 9,3 meses em toda a população. Quando selecionados os pacientes com intervalo livre de quimioterapia ≥ 90 dias, a sobrevida global mediana foi 11,9 meses, destacando-se uma taxa de sobrevida aos 12 meses de 48% nessa população. Os eventos adversos de graus ≥ 3 mais frequentes foram anemia (9%), leucopenia (29%), neutropenia (46%), trombocitopenia (7%) e neutropenia febril (5%).
Por Dr. Daniel Vargas P. de Almeida
