Continue sua leitura
Lazertinibe recebe aprovação do FDA para uso combinado com amivantamabe no tratamento do câncer de pulmão de células não pequenas
Em 19 de agosto de 2024, o FDA (Food and Drug Administration) aprovou o uso combinado de lazertinibe e amivantamabe como tratamento de primeira linha de pacientes com câncer de pulmão de células não pequenas (CPCNP) localmente avançado ou metastático com mutações de EGFR do tipo deleções no éxon 19 ou substituições L858R no éxon 21.
A aprovação foi baseada nos resultados do estudo MARIPOSA, que avaliou 1.074 pacientes com CPCNP avançado com mutações de sensibilidade do EGFR sem tratamento sistêmico prévio. Os pacientes foram randomizados (a uma razão 2:2:1) para receber lazertinibe em combinação com amivantamabe, osimertinibe em monoterapia ou lazertinibe em monoterapia. Dentre os 858 pacientes randomizados entre os grupos de lazertinibe + amivantamabe (429 pacientes) ou osimertinibe (429 pacientes), a idade mediana foi de 63 anos, com 61% dos pacientes sendo do sexo feminino. Sessenta e nove por cento dos pacientes nunca haviam fumado, 41% apresentavam metástases cerebrais e 89% foram diagnosticados inicialmente com câncer em estádio IV. Sessenta por cento dos tumores apresentavam deleções no éxon 19, enquanto os 40% restantes possuíam a mutação L858R no éxon 21 do gene EGFR.
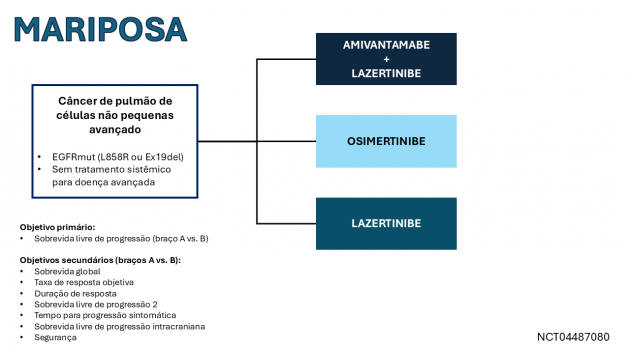
Os resultados demonstraram um benefício estatisticamente significativo na sobrevida livre de progressão para o grupo tratado com lazertinibe e amivantamabe (HR=0,70; IC de 95%: 0,58-0,85; p=0,0002), com medianas de 23,7 versus 16,6 meses. A taxa de resposta foi 78% no braço combinado versus 73% no braço de osimertinibe, com duração mediana de resposta de 25,8 versus 16,7 meses nos mesmos braços, respectivamente. Os dados de sobrevida global ainda são imaturos. Os eventos adversos mais frequentes (≥ 20%) com a combinação de lazertinibe e amivantamabe incluíram: rash cutâneo, toxicidade ungueal, reações relacionadas à infusão (amivantamabe), dor musculoesquelética, edema, estomatite, tromboembolismo venoso (TEV), parestesia, fadiga, diarreia, constipação, infecção por COVID-19, hemorragia, pele seca, diminuição do apetite, prurido, náuseas e toxicidade ocular. Devido ao risco elevado de TEV, recomenda-se anticoagulação profilática nos primeiros quatro meses de tratamento.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
