Continue sua leitura
Imunoterapias recebem duas diferentes aprovações para tratamento de tumor ginecológico nos EUA
Em junho de 2024, dois imunoterápicos diferentes foram aprovados nos Estados Unidos para o tratamento do câncer de endométrio, marcando um avanço significativo no manejo dessa doença.
No dia 14 de junho de 2024, o Food and Drug Administration (FDA) aprovou o uso de durvalumabe em combinação com carboplatina e paclitaxel, seguido por durvalumabe monoterapia, para pacientes adultas com câncer endometrial avançado ou recidivado que apresentem deficiência no mismatch repair (dMMR).
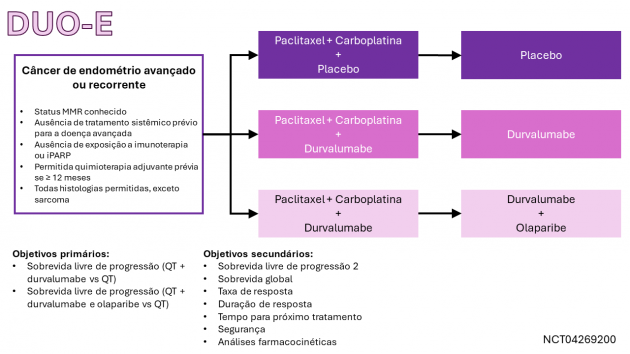
A eficácia e a segurança desta combinação foram avaliadas no estudo DUO-E, que incluiu pacientes com doença recém-diagnosticada em estádio III (com doença mensurável) ou estádio IV, além de pacientes com doença recidivada não passível de tratamento curativo com radioterapia ou cirurgia. Era permitida a exposição a quimioterapia prévia apenas no contexto adjuvante, contanto que há ≥ 12 meses. Foram incluídas pacientes com carcinomas epiteliais do endométrio de todas as histologias, incluindo carcinosarcomas, porém foram excluídas pacientes com sarcoma endometrial. Para esta aprovação foram avaliadas as pacientes randomizados entre os seguintes braços de tratamento: durvalumabe em combinação com carboplatina e paclitaxel seguidos de durvalumabe de manutenção até progressão de doença, ou placebo em combinação com carboplatina e paclitaxel seguidos de placebo de manutenção. Entre as 95 pacientes com tumores apresentando dMMR, a idade mediana foi 63 anos, 47% tinham ≥ 65 anos, 48% tinham doença recém-diagnosticada (11% no estádio III e 38% no estádio IV) e 52% com doença recidivada. Os subtipos histológicos foram: endometrioide (78%), epitelial misto (6%), carcinosarcoma (5%), seroso (4%), indiferenciado (1%) e outros (5%). Especificamente nesta população com dMMR, o tratamento contendo durvalumabe foi associado a benefício em sobrevida livre de progressão (mediana não atingida versus 7,0 meses; HR=0,42; IC de 95%: 0,22-0,80), taxa de resposta (71,4% versus 40,5%, incluindo 28,6% de respostas completas no braço durvalumabe) e duração de resposta (mediana não atingida versus 10,5 meses). Os dados de sobrevida global nessa subpopulação ainda são imaturos.
Em 17 de junho de 2024, o FDA também aprovou o uso de pembrolizumabe em combinação com carboplatina e paclitaxel, seguido por pembrolizumabe, em pacientes adultos com carcinoma endometrial avançado ou recidivado.
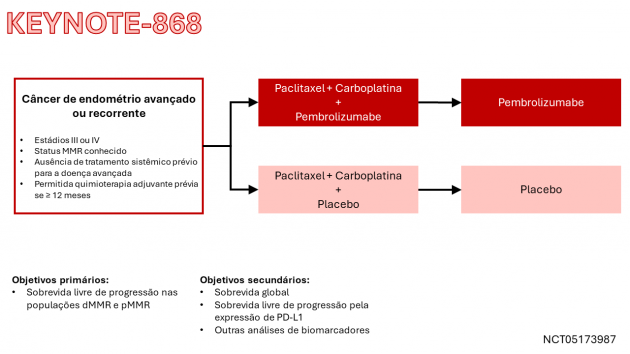
Esta combinação foi avaliada no estudo KEYNOTE-868/NRG-GY018, que incluiu 810 pacientes e foi dividido em duas coortes com base no status de mismatch repair (MMR). As pacientes foram randomizadas (1:1) para: pembrolizumabe, paclitaxel e carboplatina por 6 ciclos, seguido por pembrolizumabe por até 14 ciclos; ou placebo, paclitaxel e carboplatina por 6 ciclos, seguido por placebo por até 14 ciclos. Dentre a população dMMR, a idade mediana foi 66 anos, 55% tinham ≥ 65 anos, 61% tinham doença recidivada e 39% tinham doença primária ou persistente; 5% receberam quimioterapia adjuvante prévia e 43% receberam radioterapia prévia. Os subtipos histológicos foram: carcinoma endometrioide (81%), adenocarcinoma (11%), carcinoma seroso (2%) e outros (6%). Já na população pMMR, a idade mediana foi 66 anos, 54% tinham ≥ 65 anos, 56% tinham doença recidivada, 44% tinham doença primária ou persistente, 26% receberam quimioterapia adjuvante prévia e 41% receberam radioterapia prévia. Os subtipos histológicos foram: carcinoma endometrioide (52%), carcinoma seroso (26%), adenocarcinoma (10%), carcinoma de células claras (7%) e outros (5%). No grupo dMMR, a sobrevida livre de progressão mediana não foi atingida no braço que recebeu pembrolizumabe em comparação com 6,5 meses no grupo placebo (HR= 0,30; IC de 95%: 0,19-0,48; p<0,0001). No grupo pMMR, a sobrevida livre de progressão mediana foi de 11,1 meses no grupo pembrolizumabe, em comparação com 8,5 meses no grupo placebo (HR=0,60; IC de 95%: 0,46-0,78; p<0,0001).
A avaliação de segurança com ambos os regimes não demonstrou eventos adversos distintos do uso das combinações em diferentes cenários.
Por Dr. Daniel Vargas P. de Almeida
