Continue sua leitura
Imunoterapia aprovada para o tratamento do câncer de esôfago nos Estados Unidos
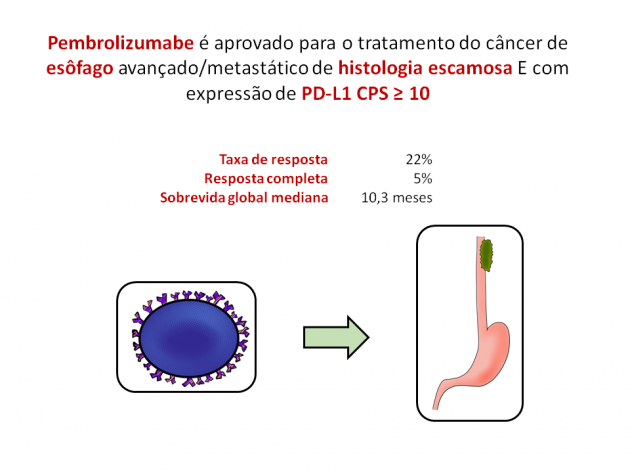
Apesar de representar apenas 1% das neoplasias diagnosticadas anualmente nos Estados Unidos, com uma incidência estimada de aproximadamente 18.000 novos casos para o ano de 2019, o tumor de esôfago possui uma sobrevida em 5 anos próxima de 20%, alcançando taxas menores do que 5% quando apresenta-se em estágios mais avançados. Com a redução do tabagismo e ingesta de álcool, a incidência do câncer de esôfago de histologia escamosa vem se reduzindo nos últimos anos no ocidente, representando < 30% dos casos nos EUA. Entretanto, o carcinoma escamoso do esôfago ainda é mais comum do que o adenocarcinoma em países menos desenvolvidos (onde a prevalência de obesidade, inclusive, é menor) como na América Latina, África e Ásia [Ann Thorac Surg 76:1367, 2003]. A recente aprovação de pembrolizumabe anunciada pelo FDA (Food and Drug Administration) em 30 de julho de 2019 vem para aumentar o arsenal de tratamentos para os pacientes com câncer de esôfago avançado com histologia escamosa e expressores de PD-L1 (CPS – combined positive score – ≥ 10) após progressão a ≥ 1 linha de tratamento sistêmico.
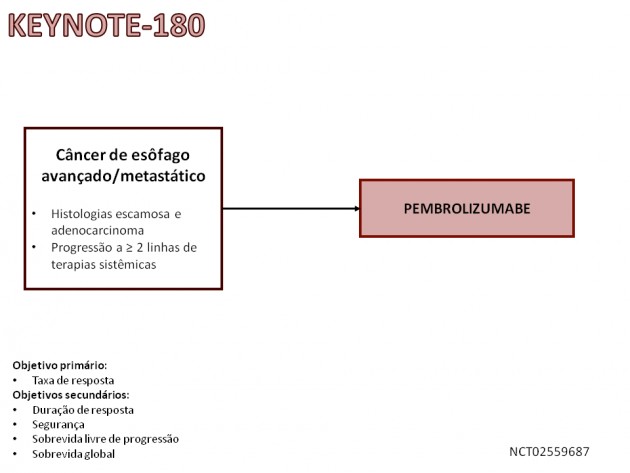
Dois estudos clínicos foram utilizados para embasar a aprovação: KEYNOTE-180 e KEYNOTE-181. No estudo de fase 2 KEYNOTE-180, o tratamento com pembrolizumabe foi avaliado em 121 pacientes com doença avançada ou metastática e progressão a ≥ 2 linhas de tratamento sistêmico. A taxa de resposta objetiva nos pacientes com tumores de histologia escamosa e expressão de PD-L1 CPS ≥ 10 foi de 20%, com duração de resposta por até 12 meses em 57% deles.
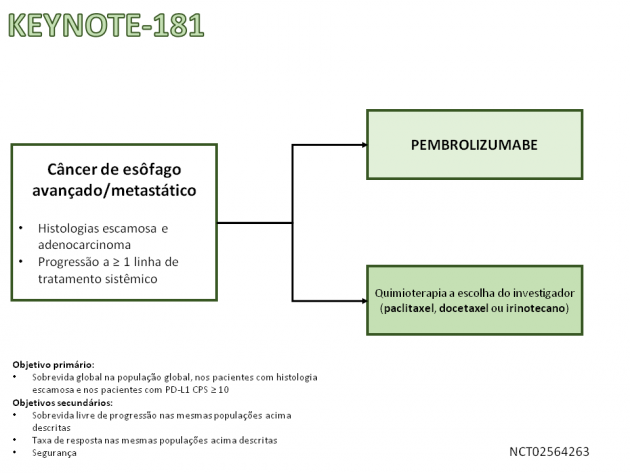
A partir dos resultados favoráveis acima descritos, o estudo de fase 3 KEYNOTE-181 foi construído. Nele foram randomizados 628 pacientes em uma distribuição 1:1 para receberem tratamento com pembrolizumabe ou quimioterapia (paclitaxel, docetaxel ou irinotecano). É importante ressaltar que os pacientes com tumores HER-2 positivos necessariamente precisavam de exposição prévia a terapia anti-HER2. O tratamento com pembrolizumabe foi associado a benefício em sobrevida global em comparação a quimioterapia quando analisados os pacientes com histologia escamosa (HR=0,77; IC de 95%:0,63-0,96), bem como nos pacientes com expressão de PD-L1 (HR=0,70; IC de 95%: 0,52-0,94). As medianas de sobrevida para os pacientes com histologia escamosa e CPS ≥ 10 foram de 10,3 versus 6,7 meses para o tratamento com pembrolizumabe e quimioterapia, respectivamente. Aqueles que receberam o imunoterápico também obtiveram maior taxa de resposta objetiva bem como resposta completa (22% e 5% versus 7% e 1%, respectivamente).
As análises de segurança de ambos os estudos demonstram eventos adversos com o uso de pembrolizumabe semelhantes aqueles demonstrados nas suas demais indicações de tratamento, e estes eventos foram menos pronunciados quando comparamos com os eventos adversos da quimioterapia.
“O FDA aplica uma interpretação distinta, mais conservadora, da interpretação dos investigadores do estudo KEYNOTE-181. Os investigadores defendiam que o benefício do tratamento com pembrolizumabe ocorria em pacientes com histologia escamosa OU hiperexpressão de PD-L1 (CPS ≥ 10), de acordo com a análise dos desfechos primários do estudo. Com isso, os pacientes com adenocarcinoma do esôfago ficarão impossibilitados de receber este tratamento, mesmo com hiperexpressão de PD-L1”, discute o Dr. Lucas V. dos Santos, oncologista da BP, a Beneficência Portuguesa de São Paulo.
“A taxa de resposta completa de 5%, algo pouco observado com quimioterapia convencional, é um resultado muito importante para estes pacientes que já falharam a terapias efetivas anteriormente”, completou.
Por Dr. Daniel Vargas P. de Almeida
