Continue sua leitura
A evolução dos teranósticos na oncologia: da imagem ao tratamento personalizado
Desde que os primeiros alvos terapêuticos começaram a ser explorados na oncologia, diferentes estratégias foram desenvolvidas para atacar as células tumorais de forma seletiva. Surgiram as pequenas moléculas, os anticorpos monoclonais, os conjugados anticorpo-droga e, mais recentemente, os radioligantes, que permitem transportar radiação de forma precisa até células que expressam um alvo específico.
O uso de radiofármacos já fazia parte da prática clínica em alguns contextos, como no câncer de tireoide tratado com iodo-131 e nos tumores neuroendócrinos com lutécio-177-dotatate. No entanto, ganhou força na oncologia com a chegada do lutécio-177-PSMA-617 (Pluvicto®, Novartis), aprovado para câncer de próstata metastático resistente à castração.
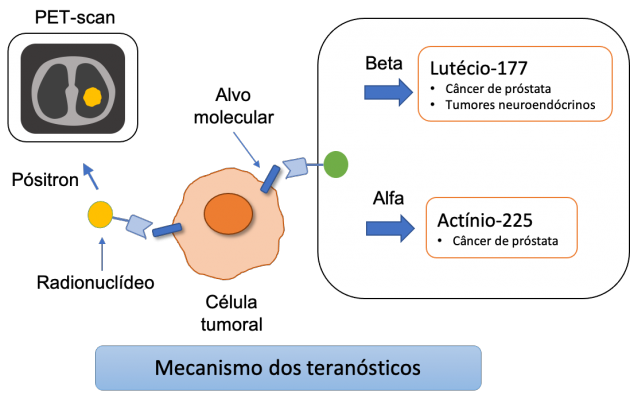
O conceito de teranóstico baseia-se na utilização de um ligante específico (peptídeo, anticorpo ou pequena molécula), capaz de se ligar seletivamente a um alvo expresso na célula tumoral. Associado a esse ligante, incorpora-se um radionuclídeo emissor de radiação. Na aplicação diagnóstica, utilizam-se radionuclídeos emissores de pósitron, como o gálio-68, permitindo visualizar a expressão do alvo através do PET-CT. Na estratégia terapêutica, a radiação pode vir na forma de partículas beta, como no caso do lutécio-177, possuem alcance tecidual de alguns milímetros (0,5–2 mm), suficiente para atingir células vizinhas, enquanto partículas alfa, como o actínio-225, possuem altíssimo poder de ionização, com alcance extremamente curto, na ordem de 50–100 micrômetros, promovendo dano altamente localizado no DNA, sobretudo com quebras duplas1.
Além do câncer de próstata e dos tumores neuroendócrinos, novos alvos estão sendo estudados em tumores como mama, pulmão e pâncreas, indicando que os teranósticos devem ganhar ainda mais espaço no tratamento oncológico.
Câncer de mama: alvo HER-2
O desenvolvimento de radiofármacos no câncer de mama HER2-positivo avançou inicialmente com a demonstração de captação seletiva nas lesões HER2-positivas com nanocorpo anti-HER-2 marcado com tecnécio-99m (NCT04674722). Posteriormente, o estudo de fase I com o nanocorpo terapêutico iodo-131-GMIB-anti-HER2-VHH1 (NCT04467515) mostrou boa captação tumoral em todos os pacientes e resposta parcial em um dos três tratados, sem toxicidade significativa. Embora interrompido por decisão estratégica, o estudo reforça o potencial dos teranósticos nesse cenário2.
Câncer de pâncreas: alvo CA19-9
No câncer de pâncreas, uma das estratégias envolve o CA19-9, marcador amplamente utilizado, que pode se elevar mesmo antes do diagnóstico definitivo da doença. A utilização do anticorpo 5B1 (anti-CA19-9) marcado com zircônio-89 demonstrou captação seletiva nas lesões, validando o alvo no contexto diagnóstico (NCT02687230). Para tratamento, o radiofármaco lutécio-177-5B1 foi avaliado em estudo de fase I (NCT03118349), com 24 pacientes com adenocarcinoma pancreático ou outros tumores CA19-9 positivos, avaliando segurança, dosimetria e dose máxima tolerada. O estudo foi encerrado em 2018, e os resultados ainda não foram publicados.
Câncer de pulmão: alvo DLL3
No câncer de pulmão de células pequenas, o DLL3, presente em 70-80% dos pacientes, vem sendo explorado como alvo terapêutico, incluindo o uso do tarlatamabe, anticorpo biespecífico para doença metastática ou recorrente após progressão a pelo menos uma linha prévia de tratamento. Na estratégia teranóstica, anticorpos anti-DLL3 marcados com zircônio-89 demonstraram captação seletiva, possibilitando o DLL3 PET-CT3. Já o radiofármaco terapêutico lutécio-177-SC16 foi avaliado em estudo pré-clínico, alcançando até 70% de respostas completas e uma toxicidade hematológica transitória e reversível, sem hepatotoxicidade significativa4.
Múltiplos tumores: alvo GRPR
Uma estratégia emergente envolve o receptor GRPR (do inglês Gastrin-Releasing Peptide Receptor), superexpresso em tumores de mama, próstata, pulmão e neuroendócrinos. O estudo em andamento NeoRay (NCT03872778), apresentado na AACR 2024, avalia o radiofármaco lutécio-177-NeoB (com alvo no GRPR) em cerca de 50 pacientes com tumores GRPR-positivos. Os desfechos incluem taxa de controle de doença, farmacocinética, biodistribuição e dosimetria. Paralelamente, no câncer de próstata metastático resistente à castração PSMA-negativo, dois estudos da Clarity Pharmaceuticals estão sendo conduzidos. O estudo SABRE, com 53 pacientes, avaliou o cobre-64-SAR-BBN direcionado ao GRPR, com taxa de detecção de 35% (dados divulgados pela empresa, ainda não publicados em revista científica). Já o estudo COMBAT, fase I/IIa, pretende incluir até 38 pacientes, combinando cobre-64-SAR-BBN para seleção por PET-CT e cobre-67-SAR-BBN para tratamento, e segue em recrutamento (NCT05633160).
Portanto, os avanços nas estratégias teranósticas têm permitido uma seleção mais assertiva dos pacientes e a entrega de tratamentos mais direcionados, com resultados clínicos promissores. Embora grande parte das plataformas em desenvolvimento ainda se encontre em fases iniciais de investigação, os dados atualmente disponíveis são consistentes e reforçam o potencial dos teranósticos como uma abordagem terapêutica inovadora, com expectativa de ampla expansão na prática oncológica nos próximos anos.
Por Dr. Caio Leite
Referências:
- Burkett BJ, et al. A Review of Theranostics: Perspectives on Emerging Approaches and Clinical Advancements. Radiol Imaging Cancer. 2023; 5(4):e220157.
- Giugliano F, et al. Radioligand Therapy in Metastatic Breast Cancer: Harnessing Precision Oncology. Cancer Treat Rev. 2025; 136:102940.
- Tendler S, et al. Imaging with [89Zr]Zr-DFO-SC16.56 anti-DLL3 antibody in patients with high-grade neuroendocrine tumours of the lung and prostate: a phase 1/2, first-in-human trial. Lancet Oncol. 2024; 25(8):1015-1024.
- Tully KM, et al. Radioimmunotherapy Targeting Delta-like Ligand 3 in Small Cell Lung Cancer Exhibits Antitumor Efficacy with Low Toxicity. Clin Cancer Res. 2022; 28(7):1391-1401.
Veja também:
