Continue sua leitura
Enzalutamida é aprovada para o tratamento do câncer de próstata recidivado de risco alto nos EUA
O anti-androgênico de nova geração enzalutamida recebeu aprovação terapêutica em um cenário inovador pelo FDA (Food and Drug Administration) no dia 16 de novembro de 2023, ao incorporar o tratamento do câncer de próstata não metastático sensível à castração (CPSCnm) com recorrência bioquímica de alto risco para o desenvolvimento de metástases (BCR de alto risco).
O agente foi avaliado nesta indicação terapêutica no estudo EMBARK, que incluiu 1.068 pacientes com CPSCnm e BCR de alto risco previamente tratados com prostatectomia radical e/ou radioterapia com intenção curativa, apresentando tempo de duplicação do PSA ≤ 9 meses e não candidatos à radioterapia de salvamento no momento da inclusão. Os pacientes foram randomizados na razão de 1:1:1 para receber enzalutamida mais leuprorrelina, enzalutamida em monoterapia ou placebo mais leuprorrelina. A idade mediana da população foi 69 anos, o tempo mediano de duplicação do PSA foi 4,9 meses, 74% dos pacientes haviam recebido prostatectomia radical, 34% haviam recebido radioterapia primária e 49% haviam recebido tanto cirurgia quanto radioterapia.
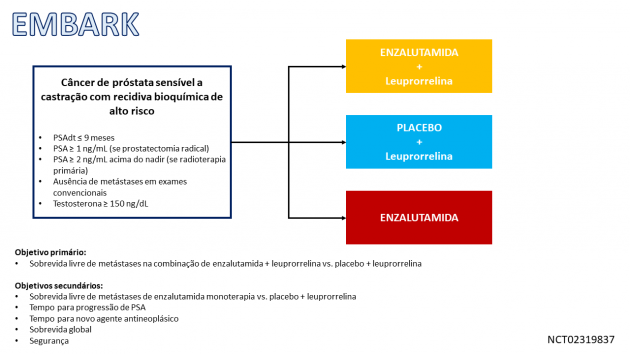
Com desfecho primário de sobrevida livre de metástase (SLM), avaliada por revisão central independente cega, o estudo demonstrou que enzalutamida mais leuprorrelina foi associado a benefício estatisticamente significativo em comparação com placebo mais leuprorrelina, com SLM mediana não atingida em ambos os braços (HR=0,42; IC de 95%: 0,30-0,61; p < 0,0001). Adicionalmente o benefício em SLM também demonstrado na comparação entre monoterapia com enzalutamida versus placebo mais leuprorrelina (HR=0,63; IC de 95%: 0,46-0,87; p = 0,0049). Os dados de sobrevida global ainda são imaturos. Os eventos adversos mais comuns (incidência ≥ 20%) em pacientes que receberam enzalutamida mais leuprorrelina foram: fogachos, dor musculoesquelética, fadiga, quedas e hemorragia. Os eventos adversos mais comuns em pacientes que receberam monoterapia com enzalutamida foram: fadiga, ginecomastia, dor musculoesquelética, sensibilidade mamária, fogachos e hemorragia.
A dose recomendada de enzalutamida é de 160 mg, via oral, uma vez ao dia, com ou sem alimentos, até a progressão da doença ou toxicidade limitante. O anti-androgênico pode ser administrado com ou sem bloqueio hormonal central. O tratamento com enzalutamida pode ser suspenso se o PSA for indetectável (< 0,2 ng/mL) após 36 semanas de terapia. O tratamento pode ser reiniciado quando o PSA aumentar para ≥ 2,0 ng/mL para pacientes que passaram por prostatectomia radical ou ≥ 5,0 ng/mL para pacientes que receberam radioterapia primária.
Por Dr. Daniel Vargas P. de Almeida
