Continue sua leitura
Durvalumabe recebe aprovação nos EUA para o tratamento perioperatório do câncer de pulmão
Em 15 de agosto de 2024, o FDA (Food and Drug Administration) aprovou o uso de durvalumabe em combinação com quimioterapia à base de platina como tratamento neoadjuvante, seguido de durvalumabe em monoterapia como tratamento adjuvante após cirurgia para pacientes adultos com câncer de pulmão de células não pequenas (CPCNP) ressecável (tumores ≥ 4 cm e/ou com comprometimento linfonodal) e sem mutações conhecidas no EGFR ou rearranjos no ALK.
Os dados que embasaram a aprovação anunciada derivam do estudo de fase III AEGEAN, que randomizou 802 pacientes com CPCNP ressecável, escamoso ou não escamoso em estádios IIA a IIIB pelo AJCC 8ª edição. Os pacientes foram randomizados para receber durvalumabe ou placebo, ambos combinados com quimioterapia à base de platina a cada 3 semanas por até 4 ciclos (tratamento neoadjuvante), seguido por durvalumabe ou placebo como monoterapia a cada 4 semanas por até 12 ciclos (tratamento adjuvante). A população do estudo incluiu pacientes com idade mediana de 65 anos, dos quais 12% no grupo durvalumabe e 9,6% no grupo placebo tinham ≥ 75 anos. A maioria dos pacientes era do sexo masculino (68,9% no grupo durvalumabe e 74,3% no grupo placebo). A maioria dos pacientes possuia histórico de tabagismo atual ou prévio (86,1% no braço durvalumabe e 85% no braço placebo). Em termos de histologia tumoral, 46,2% dos pacientes no grupo durvalumabe e 51,1% no grupo placebo tinham carcinoma escamoso.
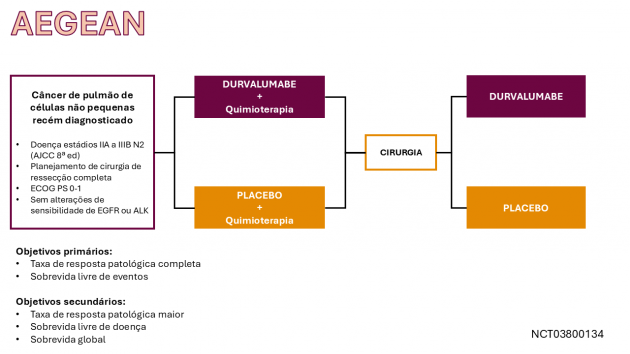
A sobrevida livre de eventos mediana não foi alcançada no braço durvalumabe, em comparação a 25,9 meses no braço placebo (HR=0,68; IC de 95%: 0,53-0,88; p=0,0039). A taxa de resposta patológica completa foi de 17% no braço durvalumabe e 4,3% no braço placebo. Na análise interina pré-especificada, os dados de sobrevida global ainda estão imaturos. Os eventos adversos mais comuns (≥20%) incluíram: anemia, náuseas, constipação, fadiga, dor musculoesquelética e rash cutâneo. Entre os pacientes que receberam durvalumabe como tratamento neoadjuvante, 1,7% não puderam realizar a cirurgia devido a eventos adversos, em comparação a 1% no grupo placebo.
Por Dr. Daniel Vargas P. de Almeida
