Continue sua leitura
Dois inibidores da PARP são aprovados para o tratamento do câncer de próstata resistente a castração nos EUA
O FDA (Food and Drug Administration) aprovou nas últimas semanas novas indicações de tratamento para dois inibidores da PARP – rucaparibe e olaparibe – regulamentando a utilização de ambos no tratamento do câncer de próstata metastático resistente a castração. A utilização de rucaparibe recebeu aprovação acelerada para o tratamento de pacientes portadores de mutação deletéria do BRCA (germinativa ou somática) com câncer de próstata metastático resistente a castração após exposição prévia a uma terapia dirigida ao receptor androgênico e a quimioterapia baseada em taxano. Já o uso de olaparibe foi aprovado para o tratamento de pacientes com câncer de próstata metastático resistente a castração apresentando mutação deletéria ou possivelmente deletéria em genes relacionados à recombinação homóloga previamente tratados com abiraterona ou enzalutamida.
Os dados que embasaram a primeira aprovação derivam da análise de 115 pacientes incluídos no estudo clínico de fase II TRITON2, que ainda se encontra em andamento. Dentre os 62 pacientes com doença mensurável, a taxa de resposta objetiva confirmada com o uso de rucaparibe foi 44%, sendo que 56% deles apresentaram duração ≥ 6 meses. A duração de resposta mediana ainda não foi atingida. Os eventos adversos mais comuns em qualquer grau com o uso de rucaparibe na população estudada foram fadiga (62%), náuseas (52%), anemia (43%), elevação de transaminases (33%) e redução do apetite (28%).
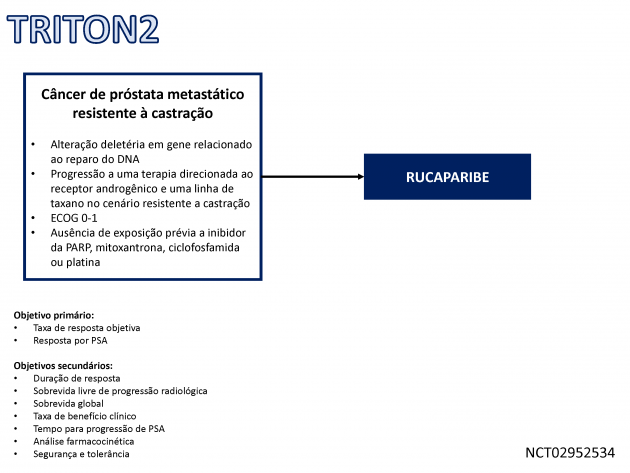
A dose recomendada para o tratamento é rucaparibe, 600 mg, duas vezes ao dia, continuamente, e a aprovação definitiva é condicionada a confirmação dos resultados em um estudo clínico de fase III em andamento (TRITON3), comparando rucaparibe a terapia de escolha do investigador.
Por outro lado, a aprovação de olaparibe é baseada nos resultados do estudo clínico de fase III PROFound que randomizou 387 pacientes com câncer de próstata metastático resistente a castração previamente tratados com abiraterona ou enzalutamida separados em duas coortes (coorte A incluindo pacientes com alterações nos genes BRCA1, BRCA2 ou ATM, e coorte B incluindo aqueles com alterações de BRIP1, BARD1, CDK12, CHEK1, CHEK2, FANCL, PALB2, PPP2R2A, RAD51B, RAD51C, RAD51D, ou RAD54L) para receberem tratamento com olaparibe ou um dos agentes hormonais à escolha do investigador (abiraterona ou enzalutamida).
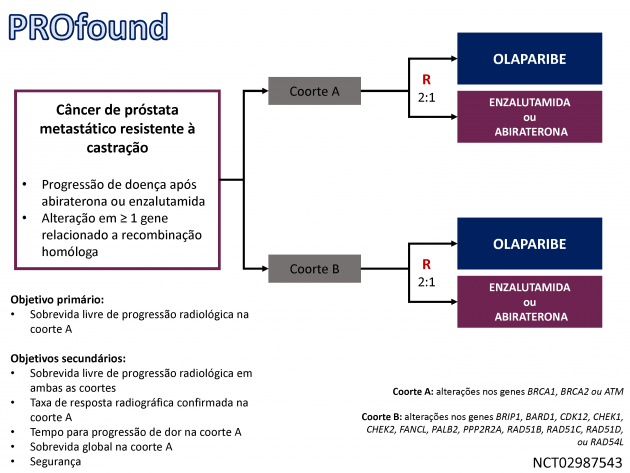
O estudo atingiu seu objetivo primário, demonstrando que o tratamento com olaparibe foi associado a maior sobrevida livre de progressão por imagem na coorte A, com medianas de 7,4 e 3,6 meses (HR=0,34; IC de 95%: 0,25-0,47; p<0,001). A sobrevida global também foi superior para o braço que recebeu olaparibe dentre os pacientes da coorte A (medianas de 18,5 e 15,1 meses, HR=0,64; IC de 95%: 0,43-0,97; p=0,02), bem como a taxa de resposta objetiva confirmada (33 versus 2%).
Quando as análises foram conduzidas em ambas as coortes combinadas, objetivos secundários do estudo, o tratamento com olaparibe também foi associado a benefício em sobrevida livre de progressão por imagem (medianas de 5,8 e 3,5 meses, HR=0,49; IC de 95%: 0,38-0,63; p<0,001), taxa de resposta objetiva confirmada (22 versus 4%) e sobrevida global (medianas de 17,5 e 14,3 meses, HR=0,67; IC de 95%: 0,49-0,93).
A taxa de eventos adversos de graus ≥ 3 com o uso de olaparibe foi 51%, destacando-se anemia, náuseas, fadiga, redução do apetite e diarreia como os eventos adversos apresentados em maior frequência.
A aprovação anunciada para o uso de olaparibe contempla todas as mutações avaliadas em ambas as coortes do estudo.
Por Dr. Daniel Vargas P. de Almeida
Veja também:
