Continue sua leitura
CAR-T em tumores sólidos: resultados promissores e perspectivas futuras
As terapias com linfócitos T modificados por receptores quiméricos (CAR-T) tornaram-se um dos maiores marcos da imunoterapia moderna. O sucesso inicial em neoplasias hematológicas, com taxas de resposta relevantes e remissões prolongadas em leucemias, linfomas e mieloma múltiplo, consolidou o conceito de reprogramação imune como ferramenta terapêutica eficaz. Desde então, avanços tecnológicos têm ampliado o potencial dessa abordagem para diferentes contextos tumorais.
O princípio terapêutico das CAR-T baseia-se na aférese de linfócitos T autólogos, posteriormente modificados por engenharia genética para expressar um receptor quimérico de antígeno (CAR) que combina o reconhecimento de um anticorpo com os sinais de ativação de um linfócito T, atuando de forma independente do MHC. Após expansão ex vivo e rigoroso controle de qualidade, as células são reinfundidas no paciente, geralmente após linfodepleção com fludarabina e ciclofosfamida, passando a reconhecer e destruir células tumorais por mecanismos de citotoxicidade direta e liberação de citocinas inflamatórias.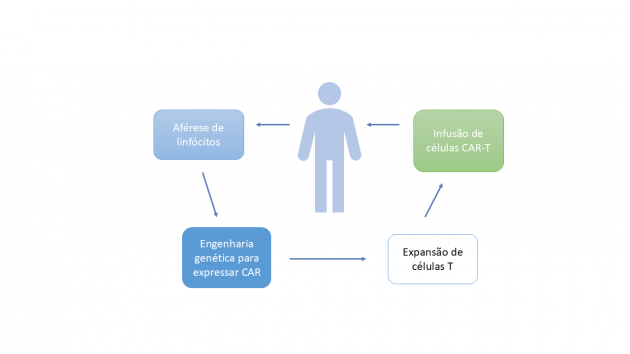
Apesar desses avanços, a tradução desse sucesso para os tumores sólidos permanece um desafio. A heterogeneidade antigênica, o estroma tumoral denso e o microambiente imunossupressor impediram, por anos, que as CAR-T reproduzissem, fora do contexto hematológico, o impacto obtido nas neoplasias de origem linfoide. Agora, contudo, evidências crescentes de estudos iniciais têm demonstrado respostas objetivas e sinais consistentes de benefício clínico, sugerindo que a terapia celular começa a superar gradualmente parte das barreiras biológicas que antes limitavam sua eficácia.
Avanços clínicos em tumores sólidos
TUMORES GASTRINTESTINAIS
O maior destaque clínico recaiu sobre a satricabtagene autoleucel (satri-cel, CT041), direcionada à claudina 18.2 (CLDN18.2), em câncer gástrico ou de junção gastroesofágica avançado refratário. No ensaio fase II randomizado CT041-ST-01, satri-cel superou o tratamento à escolha do médico, com SLP mediana de 3,25 versus 1,77 meses (HR=0,37; IC de 95%: 0,24-0,56) e síndrome de liberação de citocinas predominantemente leve e manejável1. Trata-se do primeiro ensaio controlado a demonstrar benefício clínico significativo com CAR-T em um tumor sólido.
Além de CLDN18.2, plataformas direcionadas à guanilato ciclase C (GCC19CART) vêm demonstrando atividade clínica promissora em câncer colorretal metastático refratário. Em estudo de fase I, respostas objetivas foram observadas em cerca de um terço dos pacientes, com respostas completas metabólicas isoladas, controle de doença superior a 80% e SLP mediana de 8,1 meses. A toxicidade incluiu síndrome de liberação de citocinas leve em mais de 70% dos casos e um evento isolado de enterocolite fatal2.
TUMORES UROLÓGICOS
No carcinoma renal metastático, a CAR-T alogênica anti-CD70 (ALLO-316) apresentou atividade antitumoral encorajadora em pacientes com carcinoma de células claras fortemente pré-tratados, após progressão a imunoterapia e terapias anti-VEGF. No estudo fase I TRAVERSE, com 39 pacientes, a taxa de resposta objetiva foi de 20%, alcançando 33% nos casos com alta expressão de CD70 (≥ 50%), com duração de resposta entre 2,1 e 8,4 meses. O perfil de segurança foi manejável, com síndrome de liberação de citocinas em 57% (grau ≥ 3 em 2%) e ausência de doença do enxerto contra o hospedeiro3.
Em câncer de próstata metastático resistente à castração, a CAR-T anti-PSMA modificada para resistência ao TGF-β demonstrou viabilidade clínica e atividade biológica mensurável em estudo de fase I. Entre os 13 pacientes tratados, observou-se redução de PSA em 10, sendo ≥ 30% em três casos, com perfil de segurança aceitável4.
TUMORES DO SISTEMA NERVOSO CENTRAL
No glioblastoma recorrente, a infusão intracerebroventricular de CAR-T bivalentes direcionadas a EGFR (epítopo 806) e IL-13Rα2 foi avaliada em estudo de fase I, com redução tumoral em 62% dos pacientes, resposta parcial confirmada em 8% e casos de controle prolongado superiores a 16 meses. A SLP mediana foi de 1,9 meses (IC de 90%; 1,1-3,4), e a toxicidade neurológica grau 3 ocorreu em 56%, sem eventos grau 4–5. Esses achados reforçam que, para determinados tumores cerebrais, o acesso locorregional direto pode ser determinante para potencializar a eficácia das CAR-T5.
OUTROS TUMORES SÓLIDOS DE INTERESSE CLÍNICO
Embora ainda em fase inicial de desenvolvimento, dados emergentes em tumores epiteliais prevalentes, como mama e pulmão, sugerem uma expansão gradual do uso das CAR-T para o contexto dos tumores sólidos. A maioria das evidências é proveniente de modelos pré-clínicos e ensaios de fase I, que demonstram viabilidade biológica e sinais preliminares de resposta, especialmente em plataformas direcionadas a HER-2, mesotelina e claudina 66.
Conclusões
O avanço das terapias com células CAR-T em tumores sólidos resulta da combinação de novas estratégias de engenharia celular, como a incorporação de citocinas estimuladoras (IL-12, IL-18, IL-15), edições gênicas que favorecem o fenótipo de memória, vias locoregionais de infusão como a intracraniana, e a modulação de vias imunossupressoras.
Embora ainda não haja CAR-T aprovadas para tumores sólidos, os ganhos de eficácia e segurança observados nos últimos estudos indicam que a imunoterapia celular começa a consolidar seu espaço dentro da oncologia moderna.
Por Dr. Caio Leite
Referências:
- Qi C, et al. Lancet. 2025;405(10494):2049-2060.
- Keenan BP, et al. J Clin Oncol. 2025;43(4_suppl):175.
- Srour SA, et al. J Clin Oncol. 2025;43(16_suppl):4508.
- Narayan V, et al. Nat Med. 2022;28(4):724-734.
- Bagley SJ, et al. Nat Med. 2025;31: 2778–2787.
- Li J, et al. Nat Rev Clin Oncol. 2025;22(12):953-968.
