Continue sua leitura
Capmatinibe recebe aprovação regular do FDA para tratamento do câncer de pulmão com mutação de MET
O inibidor de tirosina quinase do MET capmatinibe recebeu aprovação regular pelo FDA (Food and Drug Administration), em 10 de agosto de 2022, para o tratamento de pacientes com câncer de pulmão de células não pequenas avançado apresentando mutação do MET do tipo skipping no éxon 14.
Previamente, capmatinibe já havia recebido aprovação acelerada pela agência em maio de 2020, baseada nos dados de taxa de resposta e duração de resposta do estudo GEMOETRY mono-1. Para a conversão para aprovação regular, foram considerados os resultados do mesmo estudo após a inclusão de 63 novos pacientes e um tempo de seguimento adicional de 22 meses. O tratamento dos 160 pacientes foi realizado com capmatinibe 400 mg, via oral duas vezes ao dia. A idade mediana da população foi 71 anos, 61% eram mulheres, 61% não eram tabagistas, 83% dos pacientes apresentavam histologia adenocarcinoma e 16% possuíam metástases no sistema nervoso central. Dentre os pacientes previamente tratados, a maioria havia sido exposta apenas a um regime prévio (81%), sendo o principal regime um esquema quimioterápico baseado em platina (86%).
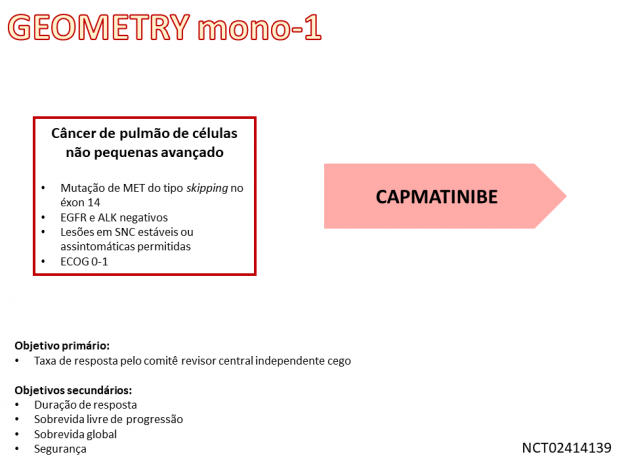
Dentre os 60 pacientes sem tratamento sistêmico prévio, a taxa de resposta foi de 68%, com duração mediana de 16,6 meses. Já nos 100 pacientes previamente expostos a tratamento sistêmico, a taxa de resposta foi de 44%, com duração mediana de 9,7 meses, sendo que aproximadamente um terço deles (36%) apresentou duração de resposta de ao menos 12 meses. A taxa de eventos adversos graves foi de 53%, destacando-se dentre estas toxicidades dispneia (7%), pneumonia (7%), derrame pleural (4,3%), dor musculoesquelética (3,8%), deterioração da saúde física (2,9%), doença intersticial pulmonar/pneumonite (2,7%) e vômitos (2,4%). Os eventos adversos mais comuns em qualquer grau foram edema, náuseas, dor musculoesquelética, fadiga, vômitos, dispneia, tosse e redução do apetite.
Conforme destaca o Dr. William William, oncologista e diretor médico da Oncologia Clínica e Hematologia do Centro Oncológico da BP – A Beneficência Portuguesa de São Paulo, “os resultados corroboram os dados que levaram à aprovação inicial do capmatinibe para câncer de pulmão de células não pequenas, fortalecem a necessidade de identificação desta alteração gênica nos perfis moleculares solicitados de rotina (inclusive em pacientes com história de tabagismo), e talvez reforcem um possível papel importante do capmatinibe como primeira linha de tratamento no contexto de mutação do MET do tipo skipping no éxon 14”.
Por Dr. Daniel Vargas P. de Almeida
