Continue sua leitura
Associação de osimertinibe a quimioterapia é aprovada nos EUA
Em 16 de fevereiro de 2024, o FDA (Food and Drug Administration) aprovou a combinação de osimertinibe com quimioterapia à base de platina para o tratamento de pacientes com câncer de pulmão de não pequenas células localmente avançado ou metastático com mutações de sensibilidade do EGFR (deleções no éxon 19 ou mutações no éxon 21 L858R).
Este regime foi avaliado no estudo de fase III FLAURA 2 que incluiu 557 pacientes que foram randomizados a uma razão 1:1 para receberem osimertinibe monoterapia ou em combinação com quimioterapia à base de platina (4 ciclos de cisplatina ou carboplatina associada a pemetrexede até progressão de doença ou toxicidade limitante). A idade mediana da população incluída foi 61 anos, 39% possuíam ≥ 65 anos, 61% eram do sexo feminino, 1,8% já haviam recebido quimioterapia previamente (em cenário neoadjuvante ou adjuvante), 61% possuíam mutação do tipo deleção do éxon 19 e 38% com mutação no éxon 21.
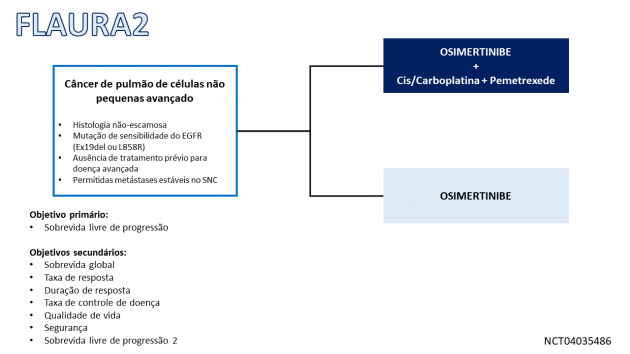
A combinação de osimertinibe e quimioterapia à base de platina demonstrou benefício na sobrevida livre de progressão em comparação à monoterapia com osimertinibe (HR=0,62; IC de de 95%: 0,49-0,79; p < 0,0001), com medianas de 25,5 versus 16,7 meses, respectivamente. Os resultados numéricos de taxa de resposta (77% versus 69%) e de duração mediana de resposta (24,9 versus 17,9 meses) também favorecem a combinação de osimertinibe a quimioterapia. A análise de sobrevida global ainda é imatura. Os eventos adversos mais frequentes (incidência ≥ 20%) em pacientes recebendo a combinação foram: leucopenia, trombocitopenia, neutropenia, linfopenia, rash, diarreia, estomatite, toxicidade ungueal, pele seca e aumento da creatinina sérica.
Por Dr. Daniel Vargas P. de Almeida
