Continue sua leitura
Afatinibe recebe nova indicação de tratamento no Brasil
A Agência Nacional de Vigilância Sanitária (ANVISA) aprovou no início de setembro de 2018 uma nova indicação de tratamento para o inibidor de tirosina quinase afatinibe no tratamento do câncer de pulmão de células não-pequenas de histologia escamosa avançado, após progressão a quimioterapia baseada em platina.
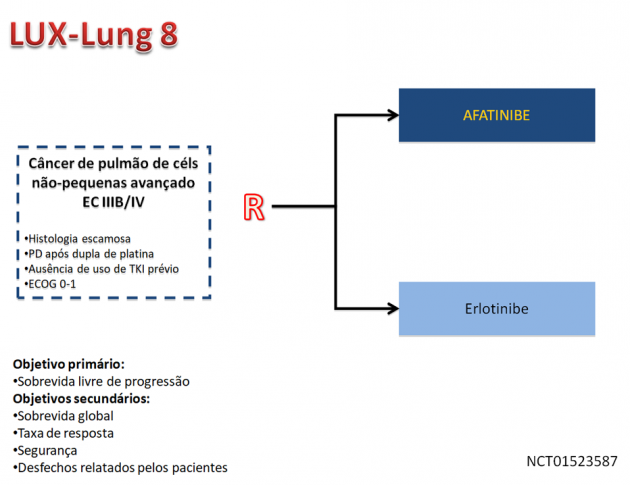
Esta aprovação é baseada no estudo LUX-Lung 8, que randomizou 795 pacientes com carcinoma escamoso de pulmão estádios IIIB ou IV após progressão a quimioterapia baseada em platina para receberem afatinibe ou erlotinibe. O estudo atingiu seu objetivo primário, promovendo benefício estatisticamente significativo em sobrevida livre de progressão em favor do grupo de pacientes tratados com afatinibe (HR 0,81; IC de 95%: 0,69-0,96; p=0,0103), e também demonstrou benefício em sobrevida global (HR 0,81; IC de 95%: 0,69-0,95; p=0,0077) e controle de doença. A taxa de eventos adversos de graus ≥ 3 foi semelhante entre os grupos (57%), porém com maior incidência de toxicidades gastrintestinais nos pacientes que receberam afatinibe, e maior incidência de toxicidades cutâneas nos pacientes tratados com erlotinibe.
Dra. Carolina Kawamura Haddad, oncologista clínica da BP – A Beneficência Portuguesa de São Paulo, ressalta que “esta aprovação representa um avanço no tratamento de resgate do câncer de pulmão de histologia escamosa, em um cenário que carecia de opções de tratamento. Embora a mutação do EGFR seja muito rara neste contexto, existe aqui um racional para o uso de afatinibe, já que tanto o EGFR como outros receptores da família ErbB podem estar hiperexpressos no câncer de pulmão de histologia escamosa”.
Por Dr. Daniel Vargas P. de Almeida