Continue sua leitura
Anticorpo biespecífico aprovado para o tratamento do mieloma múltiplo nos EUA
No dia 25 de outubro de 2022, o FDA (Food and Drug Administration) aprovou o anticorpo biespecífico teclistamabe para o tratamento de pacientes com mieloma múltiplo refratário ou recidivado que receberam ao menos 4 linhas de tratamento prévias, incluindo um inibidor de proteassoma, um agente imunomodulador e um anticorpo anti-CD38. Como o primeiro agente terapêutico desta classe a ser aprovado para o tratamento do mieloma múltiplo, teclistamabe possui um mecanismo de ação inovador através de do recrutamento de células T pela sua ligação a CD3, além de ser também dirigido ao antígeno de maturação de células B (BCMA).
A eficácia e segurança do anticorpo foram avaliadas no estudo MajesTEC-1, que incluiu 110 pacientes com mielo múltiplo previamente tratados com ≥ 3 linhas prévias, incluindo um agente imunomodulador, um anticorpo anti-CD38 e que não haviam recebido terapia direcionada a BCMA para receberem teclistamabe. A idade mediana da população avaliada foi 66 anos, incluindo 16% com ≥ 75 anos, 38% possuíam estádio II de ISS (International System Staging), 12% estádio III, 25% dos pacientes possuíam alterações citogenéticas de alto risco [del(17p), t(4;14) e t(14;16)] e 17% possuíam plasmocitomas extramedulares.
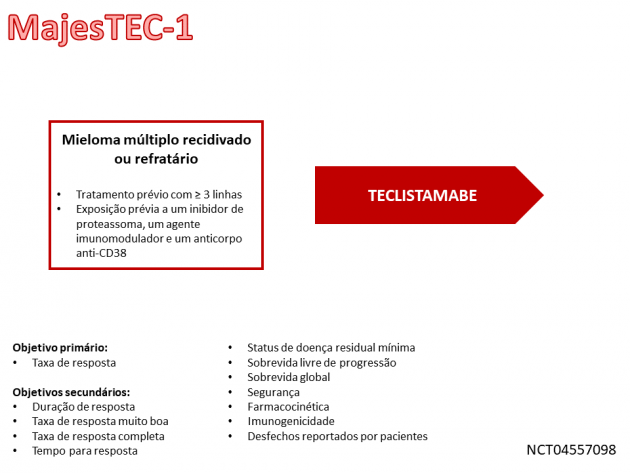
A taxa de resposta, determinada pelo comitê revisor independente através dos critérios de 2016 do International Myeloma Working Group, foi 61,8%, com duração de resposta de ao menos 9 meses em 66,5% da população. No tocante à segurança, há um destaque em relação ao risco de síndrome de liberação de citocinas (ocorrida em 72% dos pacientes) e na toxicidade neurológica medida por células imunes efetoras (apresentada por 6% da população). Os eventos adversos mais frequentes foram: febre, síndrome de liberação de citocinas, dor musculoesquelética, reação no sítio de injeção, fadiga, infecção do trato respiratório superior, náuseas, cefaleia, pneumonia e diarreia.
O Dr. Phillip Phillip Scheinberg, chefe da divisão de Hematologia Clínica da BP – A Beneficência Portuguesa de São Paulo, comenta: “a aprovação do teclistamabe era antecipada em vista dos dados apresentados nos Congressos de Hematologia. Esta é a primeira aprovação de um anticorpo biespecífico para o tratamento do mieloma múltiplo, e a segunda aprovação nas doenças onco-hematológicas em geral. Esta classe de drogas inovadora aproxima as células imune efetoras ao antígeno (alvo) tumoral, levando a respostas que impressionam em uma população já polirefratária e de alto risco. A duração de resposta e o seu posicionamento perante a terapia CAR-T será elucidado nos próximos anos. Há outros anticorpos biespecíficos sendo desenvolvidos no mieloma múltiplo e antecipam-se suas aprovações no futuro. A tendência atual, já evidenciada em estudos clínicos, é a combinação dos biespecíficos com outras drogas com atividade contra o mieloma múltiplo, cenário com estudos em andamento que possivelmente culminará, futuramente, na aplicação dos agentes biespecíficos apenas como terapia combinada. Com a aprovação do teclistamabe, os pacientes polirefratários passam a ter uma opção de tratamento efetiva, mas que apresenta eventos adversos que devem ser adequadamente manejados”.
Por Dr. Daniel Vargas P. de Almeida
