Continue sua leitura
Anticorpo anti-CD38 isatuximabe recebe novas aprovações nos EUA e no Brasil
O anticorpo monoclonal anti-CD38 isatuximabe recebeu duas novas aprovações para tratamento do mieloma múltiplo recidivado ou refratário pelo FDA (Food and Drug Administration) e pela ANVISA (Agência Nacional de Vigilância Sanitária) no último mês. Nos EUA, a indicação de uso aprovada foi em combinação a carfilzomibe e dexametasona para pacientes portadores de mieloma múltiplo previamente tratados com uma a três linhas de terapia, enquanto no Brasil, a aprovação de uso é combinada a pomalidomida e dexametasona para pacientes previamente tratados com até duas linhas prévias, incluindo lenalidomida e um inibidor de proteassoma.
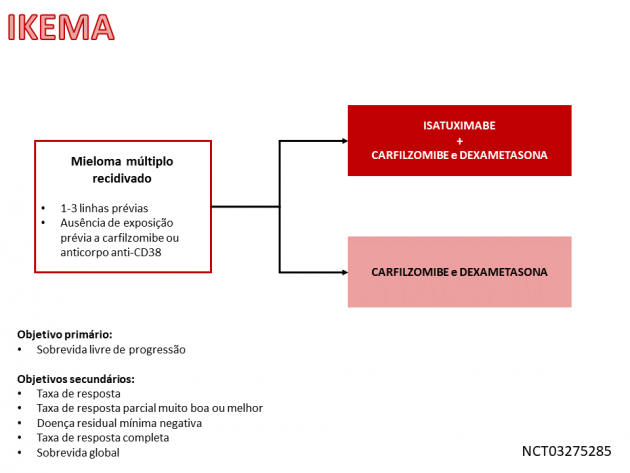
Os dados que embasam a aprovação pela agência norte-americana derivam do estudo de fase III IKEMA, que randomizou 302 pacientes entre tratamento com carfilzomibe e dexametasona combinados a isatuximabe ou não. A sobrevida livre de progressão, objetivo primário do estudo, teve mediana não alcançada no braço que recebeu o anticorpo e 20,27 meses no braço controle, representando uma redução de 45% no risco de progressão de doença ou morte (HR=0,55; IC de 95%: 0,37-0,82; p=0,0032). Em relação a segurança do tratamento, os eventos adversos apresentados em maior frequência no braço que recebeu isatuximabe foram infecções do trato respiratório superior, reações infusionais, fadiga, hipertensão arterial, diarreia, pneumonia, dispneia, insônia, bronquite, tosse e dorsalgia.
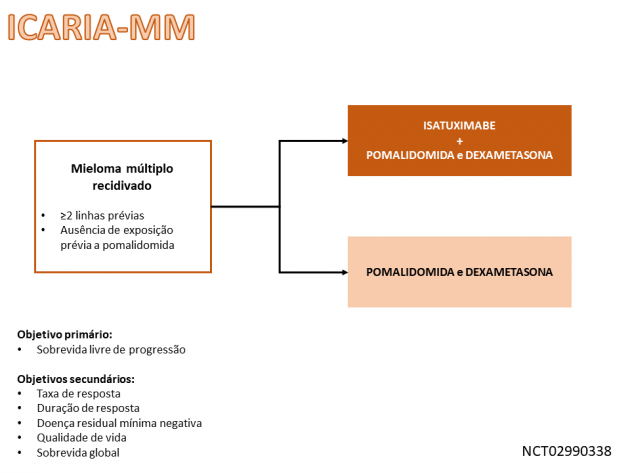
A aprovação no cenário nacional é baseada em diferentes estudos clínicos, dentre eles o ICARIA-MM, que randomizou 307 pacientes com mieloma múltiplo recidivado ou refratário previamente expostos a duas ou mais linhas de tratamento sistêmico, incluindo lenalidomida e um inibidor de proteassoma, entre receber pomalidomida e dexametasona isolados ou combinados a isatuximabe. Destaca-se que cerca de um quinto da população avaliada possuía alterações citogenéticas de alto risco. A sobrevida livre de progressão mediana foi 11,53 versus 6,47 meses para os braços isatuximabe e controle, respectivamente, objetivo primário do estudo (HR=0,596; IC de 95%: 0,44-0,81; p=0,001). Adicionalmente, a taxa de resposta também favoreceu o braço do anticorpo (60,4% versus 35,3%). Os eventos de graus ≥ 3 mais frequentes nos pacientes que receberam isatuximabe foram pneumonia, fadiga, dispneia, infecção do trato respiratório, astenia, bronquite, diarreia e dorsalgia.
O Dr. Phillip Scheinberg, chefe da divisão de Hematologia Clínica da BP, a Beneficência Portuguesa de São Paulo, destaca: “os anticorpos monoclonais por mais de 20 anos já são parte integrantes nos tratamentos para linfomas. Porém, somente nos últimos anos essas medicações foram incorporados aos regimes para mieloma múltiplo, com a introdução do daratumumabe, que reconhece o antígeno CD38. Destaca-se que a atividade de daratumumabe como agente único é modesta, apresentando maior atividade quando usado em combinação a outras terapias. A presente aprovação traz um segundo anticorpo anti-CD38 (isatuximabe) combinado a classes de drogas já consagradas como os inibidores de proteassoma (carfilzomibe) e imunomoduladores (pomalidomida) em pacientes já previamente tratados com drogas destas classes. Os estudos que substanciam a aprovação mostram benefício nas combinações que incluem o isatuximabe e com boa tolerabilidade do tratamento. Estas aprovações trazem novas opções de utilizar um anticorpo, sendo bem-vinda e ampliando o arsenal terapêutico no mieloma múltiplo”.
Por Dr. Daniel Vargas P. de Almeida
