Continue sua leitura
Estendida aprovação de pembrolizumabe para o tratamento do Linfoma de Hodgkin nos EUA
O FDA (Food and Drug Administration) anunciou em 14 de outubro de 2020 a extensão da aprovação do anticorpo anti-PD-1 pembrolizumabe para o tratamento de pacientes adultos com Linfoma de Hodgkin clássico recidivado ou refratário e de pacientes pediátricos com doença recidivada ou refratária, neste último caso sendo necessária a exposição a ≥ 2 linhas de tratamento. O uso de pembrolizumabe para o tratamento do Linfoma de Hodgkin clássico era autorizado pelo FDA desde 2017 através de uma aprovação acelerada que contemplava apenas pacientes com exposição a ≥ 3 linhas de terapia prévia.
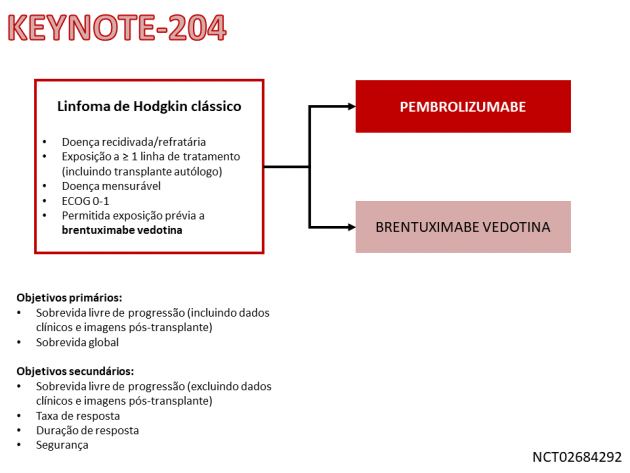
Os dados que levaram a essa extensão são resultantes do estudo de fase III KEYNOTE-204, apresentado no ASCO Virtual Meeting 2020. O estudo randomizou 304 pacientes com Linfoma de Hodgkin clássico recidivado ou refratário com exposição prévia a ≥ 1 linha de terapia sistêmica (incluindo transplante autólogo) entre pembrolizumabe ou brentuximabe vedotina administrados por até 2 anos. Dentre a população estudada, 3,3% e 6,5% dos pacientes randomizados para pembrolizumabe e brentuximabe vedotina, respectivamente, haviam recebido tratamento prévio com brentuximabe vedotina, e o número mediano de tratamentos prévios foi 2 e 3 para os mesmos grupos, respectivamente. Com um seguimento mediano de 24,7 meses, o estudo atingiu seu objetivo primário, demonstrando uma redução de 35% no risco de progressão de doença ou morte em favor do braço pembrolizumabe (HR=0,65; IC de 95%: 0,48-0,88; p=0,00271), com medianas de 13,2 versus 8,3 meses. A taxa de reposta e resposta completa foi 65,6% e 24,5% para pembrolizumabe e 54,2% e 24,2% para brentuximabe vedotina, respectivamente. A duração mediana de resposta foi maior no braço pembrolizumabe (20,7 versus 13,8 meses). Eventos adversos graves foram apresentados por 30% dos pacientes tratados com pembrolizumabe, incluindo pneumonite, pneumonia, febre, miocardite, lesão renal aguda, neutropenia febril e sepse.
A dose recomendada para essa indicação de tratamento é pembrolizumabe 200 mg intravenoso (IV) a cada 3 semanas ou 400 mg IV a cada 6 semanas para pacientes adultos, e 2 mg/kg (máximo 200 mg) IV a cada 3 semanas para pacientes pediátricos, administrado por até 2 anos.
Dra. Danielle Leão C. Farias, hematologista da BP – A Beneficência Portuguesa de São Paulo, comenta: “essa extensão traz o pembrolizumabe para fases mais inicias no Linfoma de Hodgkin recidivado/refratário. O perfil de toxicidade entre o pembrolizumabe e o brentuximabe vedotina são distintos e a duração de remissão com o uso do pembrolizumabe mais precocemente ainda será definido com seguimento maior. Outra questão é que o pembrolizumabe é ativo em pacientes previamente tratados com brentuximabe vedotina, mas o inverso, apesar de ser plausível, precisa ser definido. Com essa aprovação, a discussão passará a ser como melhor sequenciar os tratamentos no cenário recidivado/refratário no Linfoma de Hodgkin”.
Por Dr. Daniel Vargas P. de Almeida
