Continue sua leitura
Trastuzumabe deruxtecano aprovado para o tratamento do câncer de mama HER-2 positivo avançado nos Estados Unidos
O FDA (Food and Drug Administration) anunciou em 20 de dezembro a aprovação do anticorpo conjugado a droga trastuzumabe deruxtecano para o tratamento de pacientes com câncer de mama HER-2 positivo irressecável ou metastático com exposição prévia a ≥ 2 linhas de tratamento sistêmico para a doença avançada. A droga combina um anticorpo direcionado ao HER-2 conjugado a um inibidor de topoisomerase I. A aprovação é baseada nos resultados de eficácia e segurança do estudo DESTINY-Breast01, apresentado no 2019 San Antonio Breast Cancer Symposium e simultaneamente publicado no New England Journal of Medicine.
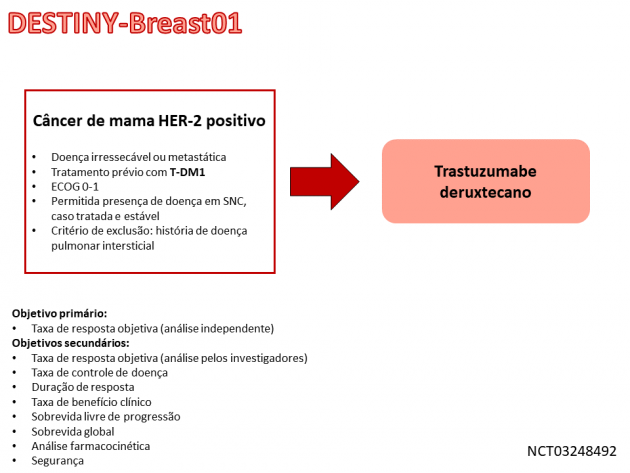
Esse estudo de fase II avaliou o tratamento com trastuzumabe deruxtecano em 184 pacientes com câncer de mama HER-2 positivo metastático com progressão a trastuzumabe emtansina. Com um seguimento mediano de 11,1 meses, 60,9% das pacientes apresentaram resposta ao tratamento, com uma duração mediana do benefício de 14,8 meses. A sobrevida livre de progressão mediana encontra-se em 16,4 meses, e a sobrevida global mediana ainda não foi atingida. Na análise de segurança do estudo, a taxa de eventos adversos de graus ≥ 3 foi de 57,1%, sendo os mais comuns nesses graus: toxicidades hematológicas (representadas por neutropenia, anemia, leucopenia e linfopenia), náuseas e fadiga. A taxa de descontinuação em decorrência de eventos adversos foi de 15,2%, incluindo toxicidade pulmonar. Ainda sobre essa toxicidade específica, 13,6% das pacientes no estudo apresentaram doença intersticial pulmonar relacionada ao tratamento em um intervalo mediano de 193 dias após o início do mesmo. A maioria dos eventos apresentados foram de graus leves (10,9% graus ≤ 2). Entretanto, 4 pacientes faleceram em decorrência dessa toxicidade.
A Dra. Juliana Martins Pimenta, oncologista da BP – A Beneficência Portuguesa de São Paulo, destaca: “importantes estudos sobre tratamento de câncer de mama metastático HER-2 positivo foram apresentados no simpósio de câncer de mama de San Antonio 2019, incluindo a apresentação dos dados desse estudo de fase II com trastuzumabe deruxtecano. Com uma alta taxa de resposta, clinicamente relevante, em pacientes previamente politratadas, essa medicação teve rápida aprovação pelo FDA e torna-se uma importante opção terapêutica para essas pacientes, sendo, no entanto, importante uma especial atenção para toxicidade associada a essa medicação, incluindo risco de toxicidade pulmonar”.
Por Dr. Daniel Vargas P. de Almeida
